引用本文: 于書靜, 王康, 李娜, 林鵬耀, 李茜, 李明銘. Toll樣受體4及相關炎性細胞因子在糖尿病大鼠視網膜中的表達. 中華眼底病雜志, 2014, 30(2): 175-179. doi: 10.3760/cma.j.issn.1005-1015.2014.02.014 復制
糖尿病患者處于一種輕度炎癥和應激狀態,可導致機體免疫系統激活[1, 2]。Toll樣受體(TLR)是機體免疫系統識別、感知細菌、病毒等病原體入侵的重要分子,在機體免疫防御功能中發揮重要作用,尤以TLR4在TLR中作用較為突出[3]。抑制TLR4信號通路可以減弱糖尿病的促炎狀態,且TLR信號通路的激活與糖尿病并發癥的發生也有著緊密聯系[4]。為明確糖尿病視網膜病變(DR)與TLR4的關系,本研究對比觀察了正常大鼠與糖尿病大鼠視網膜中TLR4、炎性細胞因子的表達水平差異,評價其視網膜中白細胞聚集與視網膜的通透性。現將結果報道如下。
1 材料和方法
Trizol RNA提取試劑盒(美國Gibco公司);逆轉錄試劑盒(大連寶生物工程有限公司);SYBR Green PCR Master Mix試劑盒購(美國應用生物公司);瓊脂糖(西班牙Biowest公司);其他試劑均為國產分析純。5415R型高速離心機(德國Eppendorf公司);GeneⅡ型DNA/RNA測定儀(瑞典Pharmacia Biosystem公司);GeneAmp 9600型普通聚合酶鏈反應(PCR)、PRISM 7000型熒光定量PCR儀(美國應用生物公司);DYCP-31D型瓊脂糖水平電泳槽(北京市六一儀器廠);Image master VDS掃描儀(瑞典Pharmacia Biotech公司)。Y99-ⅢB型超聲波細胞破碎儀(寧波新芝科器研究所);Lambdal P40紫外可見光分光光度儀(美國PE公司);Mini-ROTEAN3電泳系統與Mini Trans-Blot轉移系統(美國Bio-Rad公司);TS-1型脫色搖床(江蘇海門其林貝爾儀器制造有限公司)。
雄性Brown Norway大鼠120只,8~10周齡,體重200~250 g,清潔級,北京維通利華公司動物實驗室提供。喂養環境控制室溫在18~25 ℃,濕度50%~70%;自由攝食、飲水。適應性喂養7 d后予以隔夜禁食,不禁飲12 h,并于禁食后第2天早上稱重。隨機分為實驗組和對照組,均為60只大鼠。實驗組大鼠按體重60 mg/kg腹腔注射鏈脲佐菌素制作糖尿病模型;建模后5 d后美國強生公司快速血糖儀檢測隨機血糖,連續3 d血糖≥13.9 mmol/L為建模成功。4周后實驗前14只大鼠血糖恢復,按以上方法重新建模入組。對照組大鼠按體重1.0 ml/100 g的劑量腹腔注射檸檬酸-檸檬酸鈉緩沖液,1次。實驗組大鼠建模、對照組大鼠腹腔注射4周后處死所有大鼠,取右眼全部視網膜組織。剔除實驗過程中自然死亡14只大鼠,最終各組均為53只大鼠計入統計。
蛋白質免疫印跡法(Western blot)檢測大鼠視網膜組織中TLR4的蛋白表達。以TLR4蛋白表達為參照,與β-肌動蛋白(β-actin)表達量的比值作為組織內蛋白的相對表達水平。取約50 mg視網膜組織,加入冰冷裂解緩沖液冰浴超聲3×10 s,4 ℃下10 000×g離心5 min, 吸取上清液,Bradford法測定蛋白濃度后分裝,-80 ℃保存,備測組織裂解液內TLR4等蛋白相對表達水平。之后經過灌膠與上樣、電泳、轉膜及免疫反應,最后膠片掃描或拍照后采用凝膠圖像處理系統分析目標帶的相對分子質量和凈吸光度[A,舊稱光密度(OD)]值。
實時熒光PCR(RT-PCR)測定大鼠視網膜TLR4 mRNA表達。經過RNA提取、cDNA制備及熒光定量PCR反應。根據NCBI數據庫中的TLR4及β-actin基因序列,以Primer Premier 5.0軟件設計引物,由北京賽百盛基因技術有限公司合成序列(表 1)。20 μl PCR反應體系中含2倍SYBR Green PCR Master Mix 10 μl,cDNA 2 μl,上游引物1 μl,下游引物1 μl。擴增條件為95 ℃ 5 min變性,94 ℃ 30 s,54 ℃ 30 s,72 ℃ 1 min,共40個循環,最后72 ℃ 5 min延伸。反應結束后,根據測得樣品的循環閾值(CT)值,以2-ΔΔCT表示目的基因mRNA表達的相對值。擴增結束進行熔解曲線。
酶聯免疫吸附試驗(ELISA)測定大鼠視網膜勻漿上清液中腫瘤壞死因子-α(TNF-α)、白細胞介素(IL)-1β(IL-1β)、單核細胞趨化蛋白-1(MCP-1)等炎性細胞因子水平。加入視網膜150 μl勻漿液(20%甘油、10 mmol/L KCl、1 mmol/L MgCl2、0.1% Triton、300 mmol/L NaCl、0.5 mmol/L二硫蘇糖醇、0.1 mmol/L苯甲基磺酰氟、20 mmol/L羥乙基哌嗪乙磺酸,pH 7.9),液氮中反復凍融3次,10 min/次,其后在冰浴中超聲3次,4 s/次,4 ℃,離心半徑10 cm,10 000 r/min離心15 min。取上清液。
大鼠視網膜中白細胞聚集評價。實驗組、對照組分別選取6只大鼠,吖啶橙(AO,美國Sigma公司)以生理鹽水稀釋至1.0 mg/ml,按體重5 mg/kg經頸靜脈以1 ml/min速度注入。30 min后采用德國海德堡公司造影儀觀察,掃描密度256,圖像640(水平)像素×480(垂直)像素。取距視盤周圍直徑約5倍距離內8個區域內(以視網膜大血管為分界線)白細胞密度(細胞/像素2),計算其平均數。
視網膜通透性檢測。AO造影結束后,暴露大鼠右頸靜脈,伊凡思藍(EB,美國Sigma公司)按體重45 mg/kg在1 min內由頸靜脈緩慢注入。循環120 min后,結扎下腔靜脈,1%多聚甲醛緩沖液(pH3.5,0.05 mol/L檸檬酸緩沖液稀釋)由左心室灌注,結扎腹主動靜脈,同時剪開右心耳,灌注壓力120 mmHg(1 mmHg=0.133 kPa),灌注時間2 min。灌注結束后,立即摘除眼球,分離視網膜,4 ℃晾干稱重。將視網膜與150 μl甲酰胺(美國Sigma公司)在70 ℃下孵育8 h。然后將提取液高速離心90 min。取上清液120 μl測其A值,620、740 nm波長測定樣品的A值之差(凈A值),建立EB染料濃度在甲酰胺中的標準曲線。每一樣品測量3次,最后取其平均值。用視網膜干重(mg)標準化EB(ng)含量,結果表示為:ng/mg。
SPSS19.0統計學軟件進行統計學分析處理。數據以均數±標準差(
2 結果
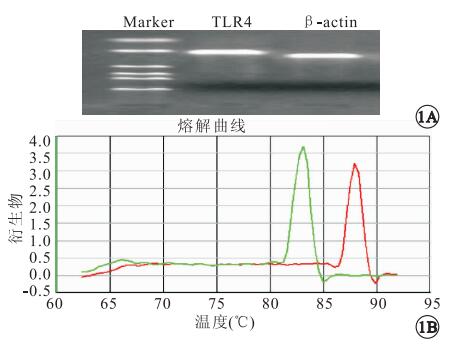
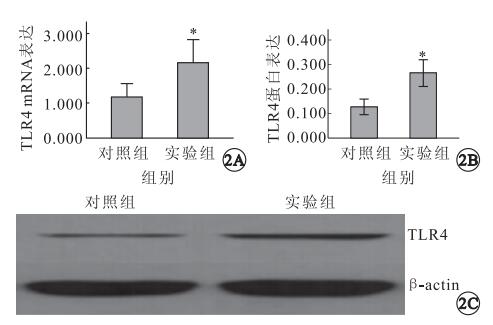
RT-PCR檢測結果顯示,TLR4和β-actin的擴增基因長度符合設計長度(圖 1A);熔解曲線圖未見其它雜峰,無非特異擴增(圖 1B)。對照組、實驗組大鼠視網膜TLR4 mRNA表達量分別為1.181±0.502、2.159±0.864,蛋白表達量分別為0.127±0.032、0.266±0.055(圖 2)。對照組、實驗組大鼠視網膜TLR4 mRNA、蛋白表達量比較,差異均有統計學意義(F=1.606、0.789,P<0.05)。
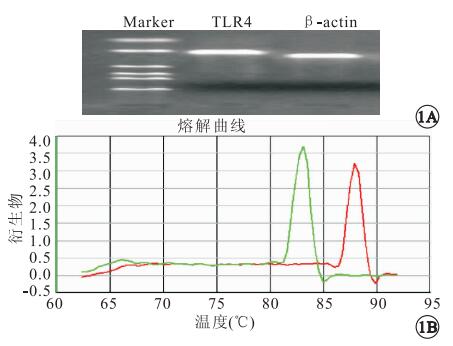 圖1
RT-PCR分析。1A.瓊脂糖凝膠電泳圖。Marker,標準分子量;β-actin,239 bp,TLR4,206 bp。1B.熔解曲線圖。綠色峰為β-actin,紅色峰為TLR4
圖1
RT-PCR分析。1A.瓊脂糖凝膠電泳圖。Marker,標準分子量;β-actin,239 bp,TLR4,206 bp。1B.熔解曲線圖。綠色峰為β-actin,紅色峰為TLR4
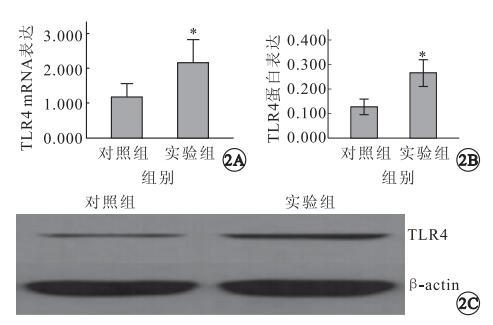 圖2
大鼠視網膜組織中TLR4 mRNA及蛋白表達。2A. mRNA表達量,n=7,*:P<0.05;2B. TLR4蛋白表達,n=4,*:P<0.05;2C. TLR4的凝膠電泳圖
圖2
大鼠視網膜組織中TLR4 mRNA及蛋白表達。2A. mRNA表達量,n=7,*:P<0.05;2B. TLR4蛋白表達,n=4,*:P<0.05;2C. TLR4的凝膠電泳圖
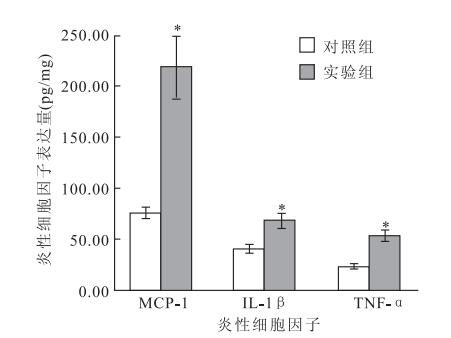
ELISA測定結果顯示,實驗組大鼠視網膜勻漿上清液中MCP-1、IL-1β、TNF-α表達均高于對照組大鼠,其中以MCP-1表達最為顯著,差異均有統計學意義(圖 3)(F=24.622、5.758、4.829,P<0.05)。
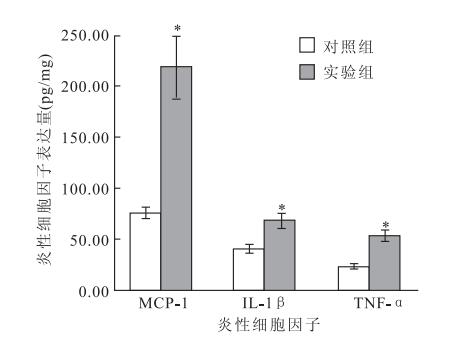 圖3
大鼠視網膜勻漿上清液中炎性細胞因子水平。n=10,*:P<0.05
圖3
大鼠視網膜勻漿上清液中炎性細胞因子水平。n=10,*:P<0.05
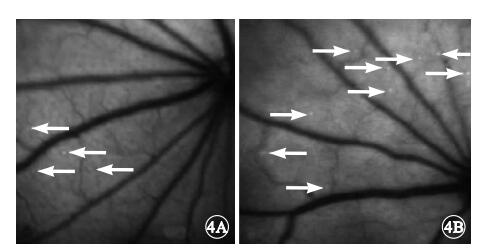
AO眼底血管造影和視網膜白細胞聚集密度評價結果顯示,對照組大鼠視網膜中可見極少數白細胞,而實驗組大鼠視網膜中白細胞明顯增多(圖 4)。實驗組、對照組大鼠視網膜中白細胞密度分別為(6.2±0.5)×10-5、(2.2±0.3)×10-5個細胞/像素2;實驗組大鼠視網膜中白細胞密度較對照組顯著增加,差異有統計學意義(F=2.025,P<0.05)。
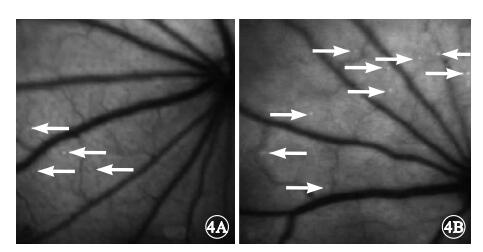 圖4
大鼠AO眼底血管造影像。4A.對照組,視網膜中極少白細胞(白箭);4B.實驗組,視網膜中白細胞明顯增多(白箭)
圖4
大鼠AO眼底血管造影像。4A.對照組,視網膜中極少白細胞(白箭);4B.實驗組,視網膜中白細胞明顯增多(白箭)
視網膜通透性檢測結果顯示,實驗組、對照組大鼠視網膜EB滲漏量分別為(23.41±4.47)、(13.22±3.59) ng/mg;實驗組大鼠視網膜EB滲漏量明顯增大,差異有統計學意義(F=21.08,P<0.05)。
3 討論
本研究選擇觀察具有代表性的TLR4,從分子水平探討其與DR發病機制的相關性。通過運用ELISA、RT-PCR、Western blot等檢測方法,比較正常大鼠視網膜與糖尿病大鼠視網膜中TLR4及炎性細胞因子的表達水平差異。結果顯示,實驗組大鼠視網膜中TLR4的表達均顯著高于對照組;實驗組大鼠視網膜勻漿上清液中TNF-α、IL-1β、MCP-1也呈高度表達,而MCP-1表達升高尤為顯著。證實了糖尿病大鼠視網膜中存在炎性細胞因子等相關基因的表達,提示TLR4信號通路與DR的發生發展可能存在密切相關。但是本研究尚有許多未詳盡之處,沒有對TLR4信號通路進行干預及動態觀察不同時間點實驗對象,因此未能證實TLR4對DR的影響關系及程度,只單純證明了DR存在TLR4信號通路及免疫系統的激活。
DR發病機制研究中血管內皮生長因子(VEGF)被認為是目前最強的新生血管生長因子,可引起血視網膜屏障破壞和新生血管增生,但是人們逐漸發現單一的抗VEGF治療遠期效果并不理想。實際上DR遠非單一因素所致,隨著TLR的研究展開,已逐步認識到DR的發生還存在復雜的免疫因素,目前許多研究提示免疫系統的活化與2型糖尿病有著密切關系[5-7]。近期研究表明,TLR信號通路激活與糖尿病并發癥的發生關系密切。TLR是機體免疫系統識別、感知細菌、病毒等病原體入侵的重要分子,通過MyD88依賴途徑與MyD88非依賴途徑,調控炎性細胞因子的表達[8]。在這些TLR家族分子成員中,TLR4對炎癥及糖尿病患者表達的內源性配體起到重要的識別作用,如氧化低密度脂蛋白、熱休克蛋白60與70、纖維蛋白原以及纖連蛋白[7]。因此本實驗選取最具代表性的TLR4通路進行研究。
TLR與DR之間的間接聯系已有報道。Mohammad等[9]首先通過糖尿病小鼠研究發現TLR與糖尿病并發癥之間的潛在聯系。其后有學者進一步證實,1型糖尿病患者體內TLR配體水平增高,并且TLR活性增加與血糖水平與成正比[10, 11]。Hodgkinson等[12]證實低密度脂蛋白晚期糖基化終末產物激活的TLR4通路,與糖尿病血管并發癥密切相關。目前有關TLR對DR影響的直接證據甚少,僅見于Buraczynska等[7]的臨床研究,他們發現TLR4的基因多態性與2型糖尿病患者發生早期DR具有密切關系。以上研究結果提示TLR與DR存在一定的關聯趨勢,但尚缺乏相關的實驗數據加以證實。本研究結果證實了TLR4信號通路與DR的發生發展可能存在密切相關,為進一步研究提供了可靠的實驗數據。
本研究結果顯示,炎性細胞因子MCP-1的表達尤為顯著,提示其與DR發生發展的相關性。MCP-1是由內皮細胞、血管平滑肌細胞和單核細胞分泌的一種趨化因子,是作用于單核細胞特異的強趨化蛋白。MCP-1激活單核細胞和巨噬細胞,上調單核細胞和巨噬細胞黏附分子以及促進IL-1、IL-6等細胞因子的產生。在多種急、慢性炎癥性疾病中,單核細胞遷移至血管內膜下層是疾病發生發展的特征性表現。有研究表明,糖尿病視網膜中血管內皮細胞產生的細胞間黏附因子-1表達增加[13],導致白細胞與其黏附性增強,血管中白細胞聚集及停滯[14, 15],共同參與DR發生,發展,并可能決定其轉歸。DR血管中白細胞停滯、聚集現象是一種較早發生的功能性改變,并可最終導致視網膜屏障破壞[16]。本研究中,對照組大鼠視網膜中白細胞密度和EB的滲透量較實驗組大鼠視網膜中白細胞密度及EB的滲透量明顯增加,證實了DR的這一改變。同時也證實了糖尿病通過刺激視網膜中的大量白細胞啟動TLR4信號通路,激活血漿中免疫細胞,增加環氧合酶-2、前列腺素2、IL-1、IL-2、干擾素-α及IL-6等正急性期蛋白和促炎細胞因子濃度,促進局部白細胞增加而堵塞毛細血管,從而直接及間接引起血管內皮細胞損傷或死亡,最終血視網膜屏障破壞[17-21]。繼而出現血漿滲漏引起出血、滲出及新生血管形成等DR的相關表現。
糖尿病患者處于一種輕度炎癥和應激狀態,可導致機體免疫系統激活[1, 2]。Toll樣受體(TLR)是機體免疫系統識別、感知細菌、病毒等病原體入侵的重要分子,在機體免疫防御功能中發揮重要作用,尤以TLR4在TLR中作用較為突出[3]。抑制TLR4信號通路可以減弱糖尿病的促炎狀態,且TLR信號通路的激活與糖尿病并發癥的發生也有著緊密聯系[4]。為明確糖尿病視網膜病變(DR)與TLR4的關系,本研究對比觀察了正常大鼠與糖尿病大鼠視網膜中TLR4、炎性細胞因子的表達水平差異,評價其視網膜中白細胞聚集與視網膜的通透性。現將結果報道如下。
1 材料和方法
Trizol RNA提取試劑盒(美國Gibco公司);逆轉錄試劑盒(大連寶生物工程有限公司);SYBR Green PCR Master Mix試劑盒購(美國應用生物公司);瓊脂糖(西班牙Biowest公司);其他試劑均為國產分析純。5415R型高速離心機(德國Eppendorf公司);GeneⅡ型DNA/RNA測定儀(瑞典Pharmacia Biosystem公司);GeneAmp 9600型普通聚合酶鏈反應(PCR)、PRISM 7000型熒光定量PCR儀(美國應用生物公司);DYCP-31D型瓊脂糖水平電泳槽(北京市六一儀器廠);Image master VDS掃描儀(瑞典Pharmacia Biotech公司)。Y99-ⅢB型超聲波細胞破碎儀(寧波新芝科器研究所);Lambdal P40紫外可見光分光光度儀(美國PE公司);Mini-ROTEAN3電泳系統與Mini Trans-Blot轉移系統(美國Bio-Rad公司);TS-1型脫色搖床(江蘇海門其林貝爾儀器制造有限公司)。
雄性Brown Norway大鼠120只,8~10周齡,體重200~250 g,清潔級,北京維通利華公司動物實驗室提供。喂養環境控制室溫在18~25 ℃,濕度50%~70%;自由攝食、飲水。適應性喂養7 d后予以隔夜禁食,不禁飲12 h,并于禁食后第2天早上稱重。隨機分為實驗組和對照組,均為60只大鼠。實驗組大鼠按體重60 mg/kg腹腔注射鏈脲佐菌素制作糖尿病模型;建模后5 d后美國強生公司快速血糖儀檢測隨機血糖,連續3 d血糖≥13.9 mmol/L為建模成功。4周后實驗前14只大鼠血糖恢復,按以上方法重新建模入組。對照組大鼠按體重1.0 ml/100 g的劑量腹腔注射檸檬酸-檸檬酸鈉緩沖液,1次。實驗組大鼠建模、對照組大鼠腹腔注射4周后處死所有大鼠,取右眼全部視網膜組織。剔除實驗過程中自然死亡14只大鼠,最終各組均為53只大鼠計入統計。
蛋白質免疫印跡法(Western blot)檢測大鼠視網膜組織中TLR4的蛋白表達。以TLR4蛋白表達為參照,與β-肌動蛋白(β-actin)表達量的比值作為組織內蛋白的相對表達水平。取約50 mg視網膜組織,加入冰冷裂解緩沖液冰浴超聲3×10 s,4 ℃下10 000×g離心5 min, 吸取上清液,Bradford法測定蛋白濃度后分裝,-80 ℃保存,備測組織裂解液內TLR4等蛋白相對表達水平。之后經過灌膠與上樣、電泳、轉膜及免疫反應,最后膠片掃描或拍照后采用凝膠圖像處理系統分析目標帶的相對分子質量和凈吸光度[A,舊稱光密度(OD)]值。
實時熒光PCR(RT-PCR)測定大鼠視網膜TLR4 mRNA表達。經過RNA提取、cDNA制備及熒光定量PCR反應。根據NCBI數據庫中的TLR4及β-actin基因序列,以Primer Premier 5.0軟件設計引物,由北京賽百盛基因技術有限公司合成序列(表 1)。20 μl PCR反應體系中含2倍SYBR Green PCR Master Mix 10 μl,cDNA 2 μl,上游引物1 μl,下游引物1 μl。擴增條件為95 ℃ 5 min變性,94 ℃ 30 s,54 ℃ 30 s,72 ℃ 1 min,共40個循環,最后72 ℃ 5 min延伸。反應結束后,根據測得樣品的循環閾值(CT)值,以2-ΔΔCT表示目的基因mRNA表達的相對值。擴增結束進行熔解曲線。
酶聯免疫吸附試驗(ELISA)測定大鼠視網膜勻漿上清液中腫瘤壞死因子-α(TNF-α)、白細胞介素(IL)-1β(IL-1β)、單核細胞趨化蛋白-1(MCP-1)等炎性細胞因子水平。加入視網膜150 μl勻漿液(20%甘油、10 mmol/L KCl、1 mmol/L MgCl2、0.1% Triton、300 mmol/L NaCl、0.5 mmol/L二硫蘇糖醇、0.1 mmol/L苯甲基磺酰氟、20 mmol/L羥乙基哌嗪乙磺酸,pH 7.9),液氮中反復凍融3次,10 min/次,其后在冰浴中超聲3次,4 s/次,4 ℃,離心半徑10 cm,10 000 r/min離心15 min。取上清液。
大鼠視網膜中白細胞聚集評價。實驗組、對照組分別選取6只大鼠,吖啶橙(AO,美國Sigma公司)以生理鹽水稀釋至1.0 mg/ml,按體重5 mg/kg經頸靜脈以1 ml/min速度注入。30 min后采用德國海德堡公司造影儀觀察,掃描密度256,圖像640(水平)像素×480(垂直)像素。取距視盤周圍直徑約5倍距離內8個區域內(以視網膜大血管為分界線)白細胞密度(細胞/像素2),計算其平均數。
視網膜通透性檢測。AO造影結束后,暴露大鼠右頸靜脈,伊凡思藍(EB,美國Sigma公司)按體重45 mg/kg在1 min內由頸靜脈緩慢注入。循環120 min后,結扎下腔靜脈,1%多聚甲醛緩沖液(pH3.5,0.05 mol/L檸檬酸緩沖液稀釋)由左心室灌注,結扎腹主動靜脈,同時剪開右心耳,灌注壓力120 mmHg(1 mmHg=0.133 kPa),灌注時間2 min。灌注結束后,立即摘除眼球,分離視網膜,4 ℃晾干稱重。將視網膜與150 μl甲酰胺(美國Sigma公司)在70 ℃下孵育8 h。然后將提取液高速離心90 min。取上清液120 μl測其A值,620、740 nm波長測定樣品的A值之差(凈A值),建立EB染料濃度在甲酰胺中的標準曲線。每一樣品測量3次,最后取其平均值。用視網膜干重(mg)標準化EB(ng)含量,結果表示為:ng/mg。
SPSS19.0統計學軟件進行統計學分析處理。數據以均數±標準差(
2 結果
RT-PCR檢測結果顯示,TLR4和β-actin的擴增基因長度符合設計長度(圖 1A);熔解曲線圖未見其它雜峰,無非特異擴增(圖 1B)。對照組、實驗組大鼠視網膜TLR4 mRNA表達量分別為1.181±0.502、2.159±0.864,蛋白表達量分別為0.127±0.032、0.266±0.055(圖 2)。對照組、實驗組大鼠視網膜TLR4 mRNA、蛋白表達量比較,差異均有統計學意義(F=1.606、0.789,P<0.05)。
 圖1
RT-PCR分析。1A.瓊脂糖凝膠電泳圖。Marker,標準分子量;β-actin,239 bp,TLR4,206 bp。1B.熔解曲線圖。綠色峰為β-actin,紅色峰為TLR4
圖1
RT-PCR分析。1A.瓊脂糖凝膠電泳圖。Marker,標準分子量;β-actin,239 bp,TLR4,206 bp。1B.熔解曲線圖。綠色峰為β-actin,紅色峰為TLR4
 圖2
大鼠視網膜組織中TLR4 mRNA及蛋白表達。2A. mRNA表達量,n=7,*:P<0.05;2B. TLR4蛋白表達,n=4,*:P<0.05;2C. TLR4的凝膠電泳圖
圖2
大鼠視網膜組織中TLR4 mRNA及蛋白表達。2A. mRNA表達量,n=7,*:P<0.05;2B. TLR4蛋白表達,n=4,*:P<0.05;2C. TLR4的凝膠電泳圖
ELISA測定結果顯示,實驗組大鼠視網膜勻漿上清液中MCP-1、IL-1β、TNF-α表達均高于對照組大鼠,其中以MCP-1表達最為顯著,差異均有統計學意義(圖 3)(F=24.622、5.758、4.829,P<0.05)。
 圖3
大鼠視網膜勻漿上清液中炎性細胞因子水平。n=10,*:P<0.05
圖3
大鼠視網膜勻漿上清液中炎性細胞因子水平。n=10,*:P<0.05
AO眼底血管造影和視網膜白細胞聚集密度評價結果顯示,對照組大鼠視網膜中可見極少數白細胞,而實驗組大鼠視網膜中白細胞明顯增多(圖 4)。實驗組、對照組大鼠視網膜中白細胞密度分別為(6.2±0.5)×10-5、(2.2±0.3)×10-5個細胞/像素2;實驗組大鼠視網膜中白細胞密度較對照組顯著增加,差異有統計學意義(F=2.025,P<0.05)。
 圖4
大鼠AO眼底血管造影像。4A.對照組,視網膜中極少白細胞(白箭);4B.實驗組,視網膜中白細胞明顯增多(白箭)
圖4
大鼠AO眼底血管造影像。4A.對照組,視網膜中極少白細胞(白箭);4B.實驗組,視網膜中白細胞明顯增多(白箭)
視網膜通透性檢測結果顯示,實驗組、對照組大鼠視網膜EB滲漏量分別為(23.41±4.47)、(13.22±3.59) ng/mg;實驗組大鼠視網膜EB滲漏量明顯增大,差異有統計學意義(F=21.08,P<0.05)。
3 討論
本研究選擇觀察具有代表性的TLR4,從分子水平探討其與DR發病機制的相關性。通過運用ELISA、RT-PCR、Western blot等檢測方法,比較正常大鼠視網膜與糖尿病大鼠視網膜中TLR4及炎性細胞因子的表達水平差異。結果顯示,實驗組大鼠視網膜中TLR4的表達均顯著高于對照組;實驗組大鼠視網膜勻漿上清液中TNF-α、IL-1β、MCP-1也呈高度表達,而MCP-1表達升高尤為顯著。證實了糖尿病大鼠視網膜中存在炎性細胞因子等相關基因的表達,提示TLR4信號通路與DR的發生發展可能存在密切相關。但是本研究尚有許多未詳盡之處,沒有對TLR4信號通路進行干預及動態觀察不同時間點實驗對象,因此未能證實TLR4對DR的影響關系及程度,只單純證明了DR存在TLR4信號通路及免疫系統的激活。
DR發病機制研究中血管內皮生長因子(VEGF)被認為是目前最強的新生血管生長因子,可引起血視網膜屏障破壞和新生血管增生,但是人們逐漸發現單一的抗VEGF治療遠期效果并不理想。實際上DR遠非單一因素所致,隨著TLR的研究展開,已逐步認識到DR的發生還存在復雜的免疫因素,目前許多研究提示免疫系統的活化與2型糖尿病有著密切關系[5-7]。近期研究表明,TLR信號通路激活與糖尿病并發癥的發生關系密切。TLR是機體免疫系統識別、感知細菌、病毒等病原體入侵的重要分子,通過MyD88依賴途徑與MyD88非依賴途徑,調控炎性細胞因子的表達[8]。在這些TLR家族分子成員中,TLR4對炎癥及糖尿病患者表達的內源性配體起到重要的識別作用,如氧化低密度脂蛋白、熱休克蛋白60與70、纖維蛋白原以及纖連蛋白[7]。因此本實驗選取最具代表性的TLR4通路進行研究。
TLR與DR之間的間接聯系已有報道。Mohammad等[9]首先通過糖尿病小鼠研究發現TLR與糖尿病并發癥之間的潛在聯系。其后有學者進一步證實,1型糖尿病患者體內TLR配體水平增高,并且TLR活性增加與血糖水平與成正比[10, 11]。Hodgkinson等[12]證實低密度脂蛋白晚期糖基化終末產物激活的TLR4通路,與糖尿病血管并發癥密切相關。目前有關TLR對DR影響的直接證據甚少,僅見于Buraczynska等[7]的臨床研究,他們發現TLR4的基因多態性與2型糖尿病患者發生早期DR具有密切關系。以上研究結果提示TLR與DR存在一定的關聯趨勢,但尚缺乏相關的實驗數據加以證實。本研究結果證實了TLR4信號通路與DR的發生發展可能存在密切相關,為進一步研究提供了可靠的實驗數據。
本研究結果顯示,炎性細胞因子MCP-1的表達尤為顯著,提示其與DR發生發展的相關性。MCP-1是由內皮細胞、血管平滑肌細胞和單核細胞分泌的一種趨化因子,是作用于單核細胞特異的強趨化蛋白。MCP-1激活單核細胞和巨噬細胞,上調單核細胞和巨噬細胞黏附分子以及促進IL-1、IL-6等細胞因子的產生。在多種急、慢性炎癥性疾病中,單核細胞遷移至血管內膜下層是疾病發生發展的特征性表現。有研究表明,糖尿病視網膜中血管內皮細胞產生的細胞間黏附因子-1表達增加[13],導致白細胞與其黏附性增強,血管中白細胞聚集及停滯[14, 15],共同參與DR發生,發展,并可能決定其轉歸。DR血管中白細胞停滯、聚集現象是一種較早發生的功能性改變,并可最終導致視網膜屏障破壞[16]。本研究中,對照組大鼠視網膜中白細胞密度和EB的滲透量較實驗組大鼠視網膜中白細胞密度及EB的滲透量明顯增加,證實了DR的這一改變。同時也證實了糖尿病通過刺激視網膜中的大量白細胞啟動TLR4信號通路,激活血漿中免疫細胞,增加環氧合酶-2、前列腺素2、IL-1、IL-2、干擾素-α及IL-6等正急性期蛋白和促炎細胞因子濃度,促進局部白細胞增加而堵塞毛細血管,從而直接及間接引起血管內皮細胞損傷或死亡,最終血視網膜屏障破壞[17-21]。繼而出現血漿滲漏引起出血、滲出及新生血管形成等DR的相關表現。