引用本文: 樓繼先, 胡昕倩, 張志勇, 李韌, 王美釵. 銀杏葉提取物對視網膜Müller細胞血管內皮生長因子表達的影響. 中華眼底病雜志, 2014, 30(2): 200-201. doi: 10.3760/cma.j.issn.1005-1015.2014.02.021 復制
研究顯示,糖尿病視網膜病變(DR)與血管內皮生長因子(VEGF)基因啟動區的多態性有關[1-3]。眼部VEGF主要由視網膜Müller細胞分泌[4],視網膜Müller細胞VEGF的生成和調節機制、阻止和逆轉DR的發生發展一直是DR研究的熱點。銀杏葉提取物(EGB761)具有抗氧化、抗病毒、抗炎、抗誘變的藥理活性,并且可作為某些酶的激動或抑制劑。因此我們觀察了不同濃度的EGB761對大鼠視網膜Müller細胞VEGF表達的影響。現將結果報道如下。
1 材料和方法
新生5~7 d的清潔級Sprague-Dawley(SD)大鼠8只,由浙江省醫學科學院動物實驗中心提供。EGB761(上海楷洋生物技術有限公司);常規重組人胰島素(江蘇萬邦生化醫藥股份有限公司);大鼠VEGF定量酶聯免疫吸附測定法(ELISA)試劑盒(武漢華美生物工程有限公司);兔抗大鼠單克隆VEGF抗體(美國Thermo Fisher Scientific公司);小鼠抗神經膠質纖維酸性蛋白(GFAP)單抗(美國Thermo Fisher Scientific公司);免疫組織化學染色試劑盒(北京博奧森生物技術有限公司);恒溫CO2培養箱(美國Thermo Elecron公司)、Powerwavex型酶標儀(澳大利亞Tecan Austria GmbH);Leica倒置相差顯鏡DMIL-LED(德國Leica儀器有限公司)。
視網膜Müller細胞的原代培養傳代及細胞的鑒定參照文獻[5]的方法進行。將即將融合的視網膜Müller細胞消化、吹打下來后,用細胞計數器計數,調整細胞密度為1×108/L,均勻接種于96孔培養板中。將其分為對照組、高胰島素組和高糖高胰島素組。每組設9孔,每孔加入200 μl培養液。培養12 h后吸出培養液,對照組用含5 mmol/L葡萄糖、不含胰島素的培養液培養;高胰島素組用含5 mmol/L葡萄糖、200 U/L胰島素的培養液培養;高糖高胰島素組用含30 mmol/L葡萄糖、200 U/L胰島素的培養液培養。置于體積分數5% CO2培養箱內在37 ℃下培養。每組在葡萄糖和(或)胰島素處理前0.5 h加入EGB761,各組調整終濃度為0、60、120 μg/ml,每組3個復孔。再于5% CO2培養箱內37 ℃繼續培養48 h。將上清液移出,按大鼠VEGF定量ELISA試劑盒說明書操作,在酶標儀450 nm波長下測定各孔的吸光度[A,舊稱光密度(OD)]值。根據標準品的濃度及對應的A值在Excel中計算出標準曲線的直線回歸方程,再根據樣品的A值計算出其對應的濃度。
預先在24孔培養板中置入蓋玻片,待傳代細胞生長接近融合時取出,吸走上清液,磷酸鹽緩沖液(PBS)清洗5 min,共3次,4%多聚甲醛固定60 min;倒掉后加入含0.5%過氧化氫的甲醇作用15 min,PBS清洗5 min,共3次,加5%山羊血清封閉20 min;加適量稀釋的小鼠抗大鼠VEGF抗體,置于37 ℃下作用1 h;PBS清洗5 min,共3次,滴加適量辣根過氧化物酶(HRP)標記的二抗(羊抗小鼠IgG),37 ℃下作用30 min;PBS清洗5 min,共3次;二氨基聯苯胺顯色,取1 ml雙蒸水加A、B、C液各1滴混勻后加至蓋玻片;室溫下顯色5~30 min,自來水沖洗終止反應;蘇木精-伊紅(HE)輕度復染3~4 min;鹽酸酒精脫水;光學顯微鏡下觀察并照相。
采用SPSS 12.0統計學軟件進行統計學分析。對均數的比較先檢驗組內方差齊性,再使用單因素方差分析,組間比較采用t檢驗,以P<0.05為差異有統計學意義。
2 結果
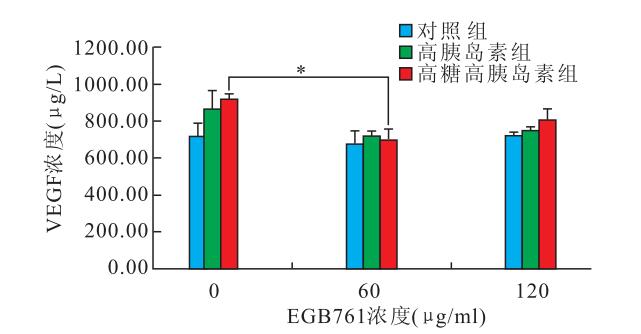
細胞胞漿內呈棕黃色的絲網狀染色,90%以上為陽性細胞。未經EGB761干預的對照組、高胰島素組和高糖高胰島素組視網膜Müller細胞中VEGF濃度分別為(721.00±68.59)、(865.75±101.94)、(923.25±21.80) μg/L。經60 μg/ml EGB761干預的對照組、高胰島素組和高糖高胰島素組視網膜Müller細胞中VEGF濃度分別為(673.04±78.67)、(722.17±24.51)、(698.04±62.17) μg/L。經120 μg/ml EGB761干預的對照組、高胰島素組和高糖高胰島素組視網膜Müller細胞中VEGF濃度分別為(720.75±19.68)、(748.54±17.97)、(810.75±54.80) μg/L(圖 1)。未經EGB761和經60 μg/ml EGB761干預的高糖高胰島素組VEGF濃度比較,差異有統計學意義(t=4.835, P<0.05)。未經EGB761和經60 μg/ml EGB761干預的高胰島素組VEGF濃度比較,差異無統計學意義(t=2.117, P>0.05)。經60 μg/ml EGB761干預的對照組和高糖高胰島素組VEGF濃度比較,差異無統計學意義(t=-0.353, P>0.05)。
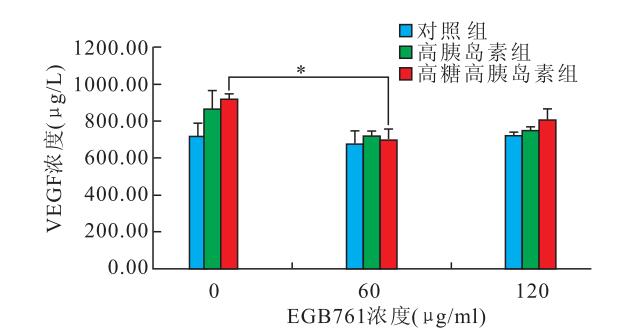 圖1
不同濃度EGB761處理各組Müller后VEGF濃度。*:P<0.05
圖1
不同濃度EGB761處理各組Müller后VEGF濃度。*:P<0.05
未經EGB761干預的高糖高胰島素組、高胰島素組視網膜Müller細胞表達VEGF較對照組增加,表現為細胞胞漿內棕黃色加深。經60、120 μg/ml EGB761干預的高糖高胰島素組、高胰島素組視網膜Müller細胞表達VEGF較對照組減少,表現為細胞胞漿內棕黃色變淺。
3 討論
VEGF在DR的發生發展中起著關鍵作用,主要由視網膜Müller細胞分泌,通過作用于視網膜血管內皮細胞上大量高親和力受體,促進血管內皮細胞的分裂、增生,進而導致視網膜新生血管的生成[4]。體外培養25~30 mmol/L的高糖水平,可近似地等同于糖尿病時體內高糖狀態,因此本實驗選用濃度為30 mmol/L的葡萄糖模擬體內的高糖條件。不同研究中所用的干預視網膜Müller細胞的胰島素濃度差異較大[6, 7],短時間內高糖對Müller細胞產生VEGF的影響相對較小且低濃度胰島素對視網膜Müller細胞無明顯影響[8]。因此,我們選用200 U/L作為高濃度胰島素。在應用胰島素的早期,胰島素可能通過激活視網膜周細胞的K+通道,膜出現去極化,引起周細胞收縮,血流減少,導致視網膜缺血缺氧,并使毛細血管通透性增強,促進DR發展。高濃度的胰島素還能促進視網膜Müller細胞中VEGF的表達,從而促使新生血管的形成[9]。本研究也表明用高濃度胰島素處理視網膜Müller細胞后VEGF濃度升高,細胞表達VEGF增加。
EGB761能夠抑制自由基,調整血脂代謝,具有抗氧化作用[10, 11]。經濃度為60、120 μg/ml的EGB761干預后均能抑制高糖高胰島素組及高胰島素組的VEGF表達,且60 μg/ml較120 μg/ml更能抑制VEGF表達。說明一定濃度的EGB761能有效抑制VEGF的過度表達和分泌,使其恢復至正常水平,對視網膜Müller細胞起到保護作用。下一步研究可采用更多濃度梯度以尋找最佳濃度及其作用機制。
DR發生發展過程中的視網膜Müller細胞及神經細胞功能及活力改變,是導致視網膜血管病變的一個主要因素[12]。在DR的早期使用藥物或者其他方法保護甚至恢復視網膜Müller細胞的正常形態結構及功能,將有助于延緩DR的進展。
研究顯示,糖尿病視網膜病變(DR)與血管內皮生長因子(VEGF)基因啟動區的多態性有關[1-3]。眼部VEGF主要由視網膜Müller細胞分泌[4],視網膜Müller細胞VEGF的生成和調節機制、阻止和逆轉DR的發生發展一直是DR研究的熱點。銀杏葉提取物(EGB761)具有抗氧化、抗病毒、抗炎、抗誘變的藥理活性,并且可作為某些酶的激動或抑制劑。因此我們觀察了不同濃度的EGB761對大鼠視網膜Müller細胞VEGF表達的影響。現將結果報道如下。
1 材料和方法
新生5~7 d的清潔級Sprague-Dawley(SD)大鼠8只,由浙江省醫學科學院動物實驗中心提供。EGB761(上海楷洋生物技術有限公司);常規重組人胰島素(江蘇萬邦生化醫藥股份有限公司);大鼠VEGF定量酶聯免疫吸附測定法(ELISA)試劑盒(武漢華美生物工程有限公司);兔抗大鼠單克隆VEGF抗體(美國Thermo Fisher Scientific公司);小鼠抗神經膠質纖維酸性蛋白(GFAP)單抗(美國Thermo Fisher Scientific公司);免疫組織化學染色試劑盒(北京博奧森生物技術有限公司);恒溫CO2培養箱(美國Thermo Elecron公司)、Powerwavex型酶標儀(澳大利亞Tecan Austria GmbH);Leica倒置相差顯鏡DMIL-LED(德國Leica儀器有限公司)。
視網膜Müller細胞的原代培養傳代及細胞的鑒定參照文獻[5]的方法進行。將即將融合的視網膜Müller細胞消化、吹打下來后,用細胞計數器計數,調整細胞密度為1×108/L,均勻接種于96孔培養板中。將其分為對照組、高胰島素組和高糖高胰島素組。每組設9孔,每孔加入200 μl培養液。培養12 h后吸出培養液,對照組用含5 mmol/L葡萄糖、不含胰島素的培養液培養;高胰島素組用含5 mmol/L葡萄糖、200 U/L胰島素的培養液培養;高糖高胰島素組用含30 mmol/L葡萄糖、200 U/L胰島素的培養液培養。置于體積分數5% CO2培養箱內在37 ℃下培養。每組在葡萄糖和(或)胰島素處理前0.5 h加入EGB761,各組調整終濃度為0、60、120 μg/ml,每組3個復孔。再于5% CO2培養箱內37 ℃繼續培養48 h。將上清液移出,按大鼠VEGF定量ELISA試劑盒說明書操作,在酶標儀450 nm波長下測定各孔的吸光度[A,舊稱光密度(OD)]值。根據標準品的濃度及對應的A值在Excel中計算出標準曲線的直線回歸方程,再根據樣品的A值計算出其對應的濃度。
預先在24孔培養板中置入蓋玻片,待傳代細胞生長接近融合時取出,吸走上清液,磷酸鹽緩沖液(PBS)清洗5 min,共3次,4%多聚甲醛固定60 min;倒掉后加入含0.5%過氧化氫的甲醇作用15 min,PBS清洗5 min,共3次,加5%山羊血清封閉20 min;加適量稀釋的小鼠抗大鼠VEGF抗體,置于37 ℃下作用1 h;PBS清洗5 min,共3次,滴加適量辣根過氧化物酶(HRP)標記的二抗(羊抗小鼠IgG),37 ℃下作用30 min;PBS清洗5 min,共3次;二氨基聯苯胺顯色,取1 ml雙蒸水加A、B、C液各1滴混勻后加至蓋玻片;室溫下顯色5~30 min,自來水沖洗終止反應;蘇木精-伊紅(HE)輕度復染3~4 min;鹽酸酒精脫水;光學顯微鏡下觀察并照相。
采用SPSS 12.0統計學軟件進行統計學分析。對均數的比較先檢驗組內方差齊性,再使用單因素方差分析,組間比較采用t檢驗,以P<0.05為差異有統計學意義。
2 結果
細胞胞漿內呈棕黃色的絲網狀染色,90%以上為陽性細胞。未經EGB761干預的對照組、高胰島素組和高糖高胰島素組視網膜Müller細胞中VEGF濃度分別為(721.00±68.59)、(865.75±101.94)、(923.25±21.80) μg/L。經60 μg/ml EGB761干預的對照組、高胰島素組和高糖高胰島素組視網膜Müller細胞中VEGF濃度分別為(673.04±78.67)、(722.17±24.51)、(698.04±62.17) μg/L。經120 μg/ml EGB761干預的對照組、高胰島素組和高糖高胰島素組視網膜Müller細胞中VEGF濃度分別為(720.75±19.68)、(748.54±17.97)、(810.75±54.80) μg/L(圖 1)。未經EGB761和經60 μg/ml EGB761干預的高糖高胰島素組VEGF濃度比較,差異有統計學意義(t=4.835, P<0.05)。未經EGB761和經60 μg/ml EGB761干預的高胰島素組VEGF濃度比較,差異無統計學意義(t=2.117, P>0.05)。經60 μg/ml EGB761干預的對照組和高糖高胰島素組VEGF濃度比較,差異無統計學意義(t=-0.353, P>0.05)。
 圖1
不同濃度EGB761處理各組Müller后VEGF濃度。*:P<0.05
圖1
不同濃度EGB761處理各組Müller后VEGF濃度。*:P<0.05
未經EGB761干預的高糖高胰島素組、高胰島素組視網膜Müller細胞表達VEGF較對照組增加,表現為細胞胞漿內棕黃色加深。經60、120 μg/ml EGB761干預的高糖高胰島素組、高胰島素組視網膜Müller細胞表達VEGF較對照組減少,表現為細胞胞漿內棕黃色變淺。
3 討論
VEGF在DR的發生發展中起著關鍵作用,主要由視網膜Müller細胞分泌,通過作用于視網膜血管內皮細胞上大量高親和力受體,促進血管內皮細胞的分裂、增生,進而導致視網膜新生血管的生成[4]。體外培養25~30 mmol/L的高糖水平,可近似地等同于糖尿病時體內高糖狀態,因此本實驗選用濃度為30 mmol/L的葡萄糖模擬體內的高糖條件。不同研究中所用的干預視網膜Müller細胞的胰島素濃度差異較大[6, 7],短時間內高糖對Müller細胞產生VEGF的影響相對較小且低濃度胰島素對視網膜Müller細胞無明顯影響[8]。因此,我們選用200 U/L作為高濃度胰島素。在應用胰島素的早期,胰島素可能通過激活視網膜周細胞的K+通道,膜出現去極化,引起周細胞收縮,血流減少,導致視網膜缺血缺氧,并使毛細血管通透性增強,促進DR發展。高濃度的胰島素還能促進視網膜Müller細胞中VEGF的表達,從而促使新生血管的形成[9]。本研究也表明用高濃度胰島素處理視網膜Müller細胞后VEGF濃度升高,細胞表達VEGF增加。
EGB761能夠抑制自由基,調整血脂代謝,具有抗氧化作用[10, 11]。經濃度為60、120 μg/ml的EGB761干預后均能抑制高糖高胰島素組及高胰島素組的VEGF表達,且60 μg/ml較120 μg/ml更能抑制VEGF表達。說明一定濃度的EGB761能有效抑制VEGF的過度表達和分泌,使其恢復至正常水平,對視網膜Müller細胞起到保護作用。下一步研究可采用更多濃度梯度以尋找最佳濃度及其作用機制。
DR發生發展過程中的視網膜Müller細胞及神經細胞功能及活力改變,是導致視網膜血管病變的一個主要因素[12]。在DR的早期使用藥物或者其他方法保護甚至恢復視網膜Müller細胞的正常形態結構及功能,將有助于延緩DR的進展。