引用本文: 彭春霞, 曹珊珊, 趙朔, 康皓, 周歡粉, 楊沫, 徐全剛, 魏世輝. 水通道蛋白-4抗體陽性視神經炎患者視網膜神經纖維層及黃斑區內層視網膜結構改變觀察. 中華眼底病雜志, 2015, 31(6): 536-540. doi: 10.3760/cma.j.issn.1005-1015.2015.06.006 復制
視神經脊髓炎(NMO)和多發性硬化(MS)是中樞神經系統(CNS)受累的自身免疫性脫髓鞘疾病,兩者常首先累及視神經,以視神經炎(ON)為首發癥狀而就診于眼科[1]。但兩者發病機制不同,NMO以B淋巴細胞介導的體液免疫為主,而MS以T淋巴細胞介導的免疫為主,故治療及預后亦不同[1, 2],因此早期準確診斷至關重要。視網膜神經纖維層(RNFL)到大腦枕葉皮質中樞的視覺通路是CNS的重要組成部分。RNFL具備CNS軸索特性,視網膜神經節細胞(RGC)具備CNS神經元的基本特征。所以采用光相干斷層掃描(OCT)技術觀察RGC、RNFL的變化可為判斷CNS神經元病變提供依據。水通道蛋白-4(AQP4)抗體(AQP4-Ab)陽性的ON患者與NMO臨床表現極其相似,轉化為NMO風險較高,稱為譜系疾病(NMOSD)[1, 3]。我們對一組ON患者進行了OCT檢查,對比觀察血清AQP4-Ab陽性ON[(AQP4-Ab(+)ON)]、血清AQP4-Ab陰性ON[(AQP4-Ab(-)ON)]患者以及正常對照者視盤RNFL厚度及黃斑區內層視網膜結構改變,以期尋找早期診斷NMOSD的結構性標志。現將結果報道如下。
1 對象和方法
2014年9月至2015年9月在解放軍總醫院眼科檢查確診的ON患者60例84只眼(ON組)納入研究。其中,男性16例25只眼,女性44例59只眼。年齡17~66歲,平均年齡(39.06±13.30)歲。病程≤6個月者42只眼,>6個月者42只眼。均行最佳矯正視力(BCVA)、眼前節、眼底及OCT檢查。
BCVA檢查為Snellen視力表,記錄時換算為最小分辨角對數(logMAR)視力。數指=logMAR1/41.85, 手動=logMAR1/42.3, 光感=logMAR1/42.7, 無光感=logMAR1/43.0[5]。檢查結果符合ON治療試驗診斷標準[4]。排除標準:(1)屈光度≥±6.00 DS,散光≥±2.00 DC;(2)視盤水腫;(3)既往有除ON以外的眼病或眼部手術史;(4)患有CNS疾病者。
根據血清AQP4-Ab檢查結果,將ON組分為AQP4-Ab(+)ON組、AQP4-Ab(-)ON組,均為30例42只眼。AQP4-Ab(+)ON組42只眼中,男性12只眼,女性30只眼;平均年齡(39.95±13.75)歲;病程≤6個月者19只眼,>6個月者23只眼;平均logMAR BCVA 0.98±0.93。AQP4-Ab(-)ON組42只眼中,男性13只眼,女性29只眼;平均年齡(38.17±12.94)歲;病程≤6個月者19只眼,>6個月者23只眼;平均logMAR BCVA 0.73±0.89。選取同期本院工作人員和與患者無血緣關系的家屬40名80只眼作為正常對照組(HC組)。其中,男性14名28只眼,女性26名52只眼;平均年齡(36.66±11.62)歲。視力、眼壓正常,無眼部疾病史。3組受檢者間性別(χ2=0.568)、年齡(χ2=1.472)比較,差異無統計學意義(P=0.732、0.732)。AQP4-Ab(-)ON組、AQP4-Ab(+)ON組間不同病程眼數(χ2=0.000)、平均logMAR BCVA(Z=-1.492)比較,差異無統計學意義(P=1.000、0.136)。
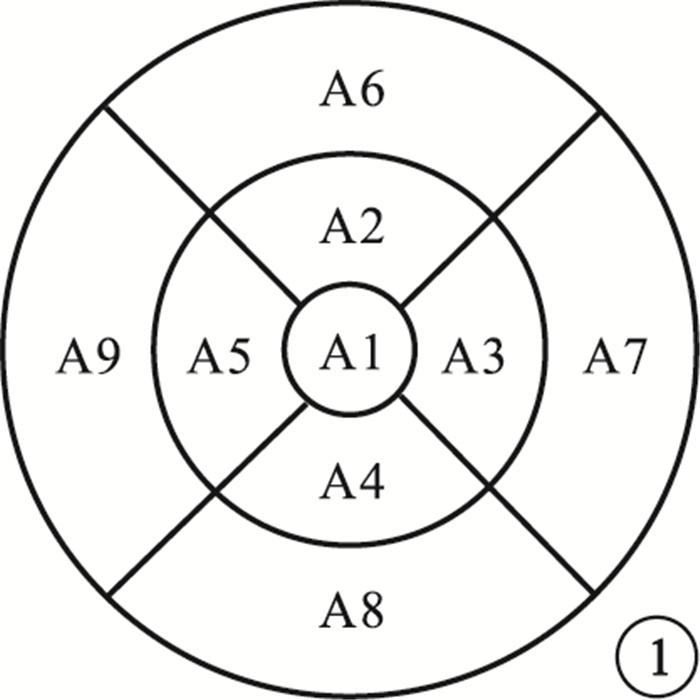
OCT檢查采用德國Heidelberg公司Spectralis-OCT儀行視盤及黃斑區掃描。應用標準視神經掃描模式(nisite)的盤周RNFL(pRNFL)程序,對盤周及其鼻側、鼻下、顳下、顳側、顳上、鼻上象限和盤斑束(PMB)RNFL厚度以及鼻側、顳側RNFL平均厚度比(N/T))進行分析。根據糖尿病視網膜病變早期治療研究制訂的標準[6],將黃斑部劃分為以黃斑中心凹為中心的3個同心圓, 分別為直徑1 mm的中心區,1 mm<直徑≤3 mm的內環區,3 mm<直徑≤6 mm的外環區;在內外環分別有2條放射線將其分為上下左右4區,共9個區(圖 1)。以A1代表中心區;A2、A3、A4、A5分別代表內環區的上方、顳側、下方、鼻側;A6、A7、A8、A9分別代表外環區的上方、顳側、下方、鼻側。應用黃斑程序對A1外其他8個分區的黃斑容積及黃斑部RNFL(mRNFL)、黃斑部RCG層(mRGCL)、黃斑部內叢狀層(mIPL)、黃斑部內核層(mINL)容積進行分析。
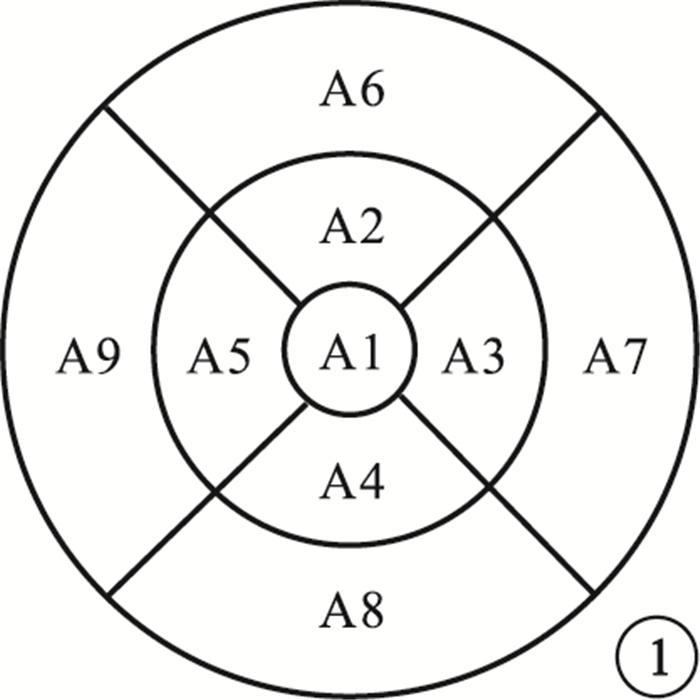 圖1
黃斑部9個分區示意圖
圖1
黃斑部9個分區示意圖
采用SPSS 17.0統計學軟件進行統計分析處理。組間性別、病程比較行χ2檢驗;年齡比較行非參數檢驗的Kruskal-Walliss檢驗;logMAR BCVA比較行非參數Mann-Whitney檢驗。各組間均數比較采用兩兩比較的方差分析法或t檢驗,方差齊采用最小顯著差法,方差不齊采用Games-Howell法。P<0.05為差異有統計學意義。
2 結果
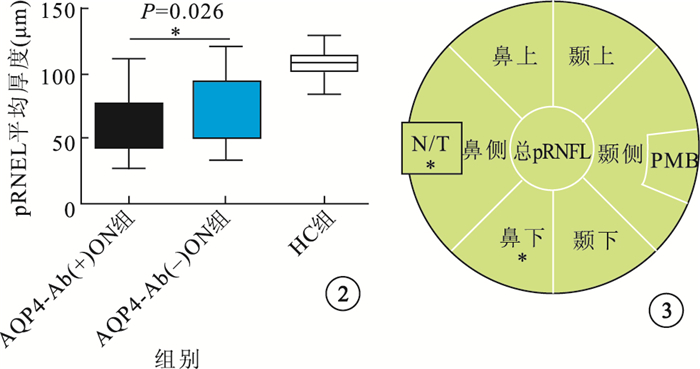
與HC組比較,ON組患眼總pRNFL平均厚度(圖 2)及視盤各象限、PMB平均RNFL厚度均明顯降低,差異有統學意義(P=0.000)。AQP4-Ab(+)ON組pRNFL平均厚度,視盤各象限、PMB平均RNFL厚度均較AQP4-Ab(-)ON組降低。其中,視盤鼻側及鼻下象限RNFL厚度差異有統計學意義(P=0.010、0.000)。兩組患眼間N/T差異有統計學意義(圖 3)。
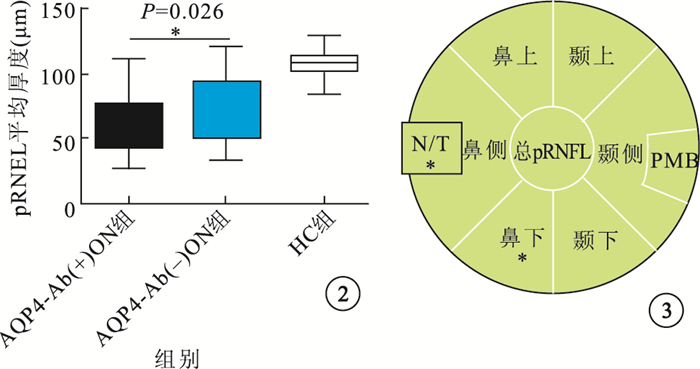 圖2
3組受檢眼pRNFL厚度比較。*P<0.05 ?圖 3 AQP4-Ab(+)ON組,AQP4-Ab(-)ON組患眼pRNFL厚度。與AQP4-Ab(-)ON組患眼比較,*P<0.01
圖2
3組受檢眼pRNFL厚度比較。*P<0.05 ?圖 3 AQP4-Ab(+)ON組,AQP4-Ab(-)ON組患眼pRNFL厚度。與AQP4-Ab(-)ON組患眼比較,*P<0.01
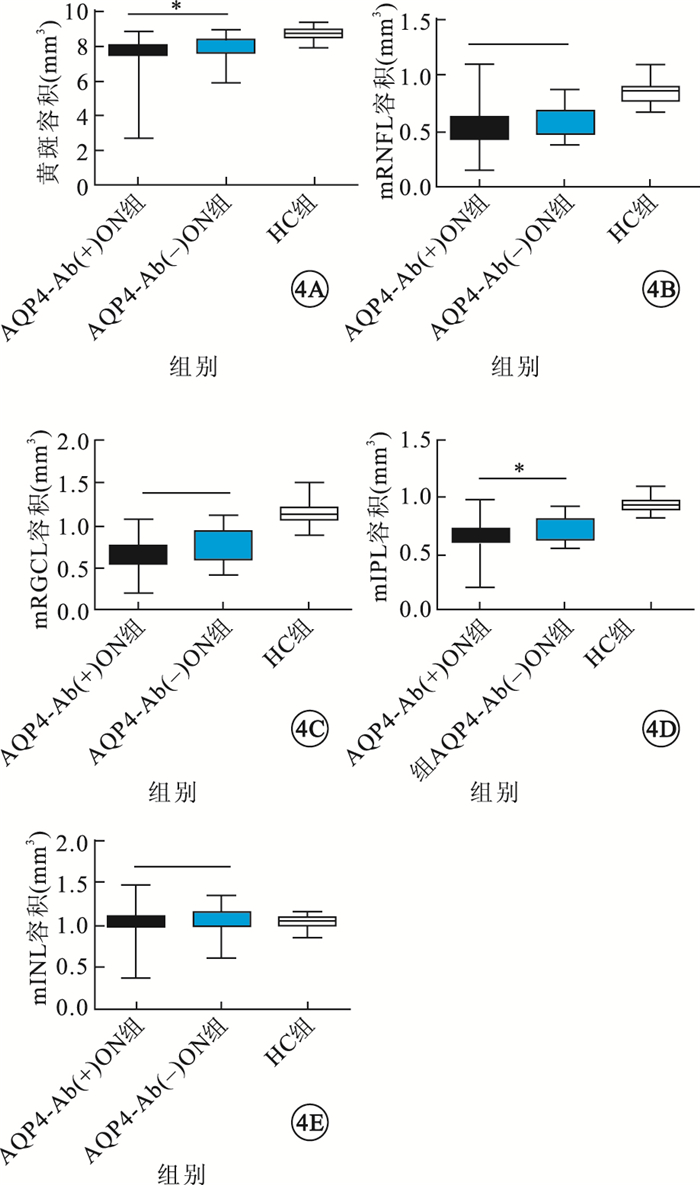
與HC組比較,ON組患眼黃斑容積及mRNFL、mRGCL、mIPL容積明顯減小,差異有統計學意義(P=0.000、0.000、0.000);mINL容積無明顯變化,差異無統計學意義(P=0.700)。AQP4-Ab(+)ON組患眼黃斑容積及mRNFL、mRGCL、mIPL容積較AQP4-Ab(-)ON組患眼減小,其中黃斑容積、mIPL容積減小程度差異有統計學意義(P=0.038、0.033)(圖 4)。與AQP4-Ab(-)ON組患眼比較,AQP4-Ab(+)ON組患眼外環下方區域黃斑平均容積,外環上方、下方區域mIPL平均容積,內環鼻側區域mRNFL平均容積減小更多,差異有統計學意義(P<0.05)(圖 5)。
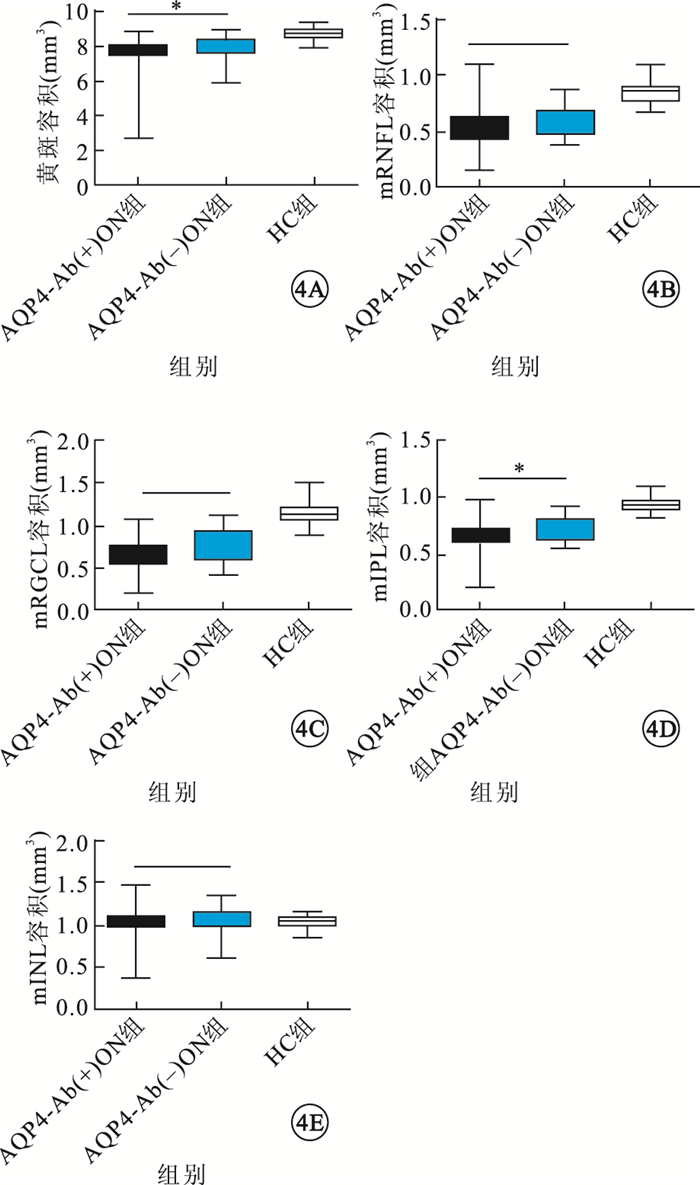 圖4
3組受檢眼黃斑容積、mRNFL容積、mRGCL容積、mIPL容積、mINL容積比較。4A~4E.分別為黃斑容積、mRNFL容積、mRGCL容積、mIPL容積、mINL容積。*P<0.05
圖4
3組受檢眼黃斑容積、mRNFL容積、mRGCL容積、mIPL容積、mINL容積比較。4A~4E.分別為黃斑容積、mRNFL容積、mRGCL容積、mIPL容積、mINL容積。*P<0.05
 圖5
AQP4-Ab(+)ON組、AQP4-Ab(-)ON組患眼黃斑各層損傷空間分布圖。5A~5E.分別為黃斑容積、mRNFL容積、mRGCL容積、mIPL容積、mINL容積。*與AQP4-Ab(-)ON組患眼比較,P<0.05
圖5
AQP4-Ab(+)ON組、AQP4-Ab(-)ON組患眼黃斑各層損傷空間分布圖。5A~5E.分別為黃斑容積、mRNFL容積、mRGCL容積、mIPL容積、mINL容積。*與AQP4-Ab(-)ON組患眼比較,P<0.05
3 討論
Ratchford等[7]對26例NMO-ON患者和378例MS患者進行觀察,發現前者pRNFL較后者更嚴重。首次ON發作后,NMO-ON患者pRNFL丟失比MS-ON患者多24 μm。由此作者提出,如果非MS患者發生ON后,pRNFL丟失大于15 μm,應該考慮NMO-ON可能性大。繼而Naismith等[8]采用OCT對22例NMO-ON患者和47例MS患者的pRNFL進行了測量,得到相同的結果。且發現首次ON發作后,pRNFL厚度每變薄1 μm,轉變成NMO的可能性就增加8%。Monteiro等[9]比較了45只MS-ON患眼和62只NMO-ON患眼,也發現pRNFL厚度的丟失,NMO-ON患眼比MS-ON患眼嚴重。與本研究AQP4-Ab(+)ON患眼pRNFL厚度比AQP4-Ab (-)ON患眼pRNFL厚度變薄結論相似。首次ON發作后,NMO-ON不但造成嚴重的pRNFL及視功能的丟失,而且對mRNFL損傷也較MS-ON重。Schneider等[10]對17例NMOSD-ON患者與17例MS-ON患者進行觀察,發現NMOSD-ON患者mRNFL丟失較MS-ON患者嚴重。Fernandes等[11]比較了29例NMO-ON患者與29例MS-ON患者的mRNFL容積,發現NMO-ON患者mRNFL厚度比MS-ON患者變薄,但差異無統計學意義。這些結果與本研究的結果基本相似,原因可能是因為NMO的發病機制與MS有所不同。NMO或NMOSD不僅造成神經纖維的脫髓鞘性損傷、而且造成神經壞死、空洞化[12];相比MS單一的脫髓鞘性改變,結構損傷也更重。另外Naismith等[8]研究還發現,NMO-ON患眼與MS-ON患眼相比,pRFNL厚度變薄在分布部位上也明顯不同。在兩組患眼對比視敏度無差異的情況下,NMO-ON患眼pRNFL丟失主要分布在上方、下方及鼻側。在Monteiro等[9]的研究中,也發現相同分分布特點。這一結果與本研究在控制視力損傷一致的情況下,AQP4-Ab(+)ON組患眼pRNFL的丟失主要分布于鼻側及下方的結果基本一致。這些特點可能與AQP4表達的分布有關。它主要表達在血管周圍星形膠質細胞的足突上,參與血腦屏障的形成。所以在視盤周圍上方、下方及鼻側,血管分布豐富的區域造成的神經損傷重,神經纖維丟失的也最明顯。
本研究發現,AQP4-Ab(+)ON組患眼在黃斑內環鼻側mRNFL平均容積丟失比AQP4-Ab(-)ON組患眼重。這種現象的機制尚不清楚,但這一結果或許能解釋NMO-ON比MS-ON患眼視力預后差的特點[10]。
尸體眼解剖發現,70%的MS患者出現RGC丟失[13, 14]。采用OCT觀察MS-ON及NMO-ON患眼的研究發現,mRGCL+mIPL厚度及黃斑厚度較正常眼明顯變薄[10, 15]。Kerrison等[13]研究發現,NMO-ON患眼的黃斑厚度比MS-ON丟失要更嚴重。這與本研究結果AQP4-Ab(+)ON組患眼比AQP4-Ab(-)ON組患眼黃斑容積丟失更重結果一致。Fernandes等[11]進一步分析了NMO-ON、MS-ON患眼mRGCL+mIPL厚度,發現NMO-ON患眼比MS-ON患眼變薄,但差異無統計學意義。與本研究AQP4-Ab(+)ON組患眼mRGCL容積丟失比AQP4-Ab(-)ON組多,但差別無統計學意義結果相一致。Schneider等[10]分析了NMO-ON患眼與MS-ON患眼mRGCL厚度變化情況,發現NMO-ON患眼比MS-ON患眼明顯變薄,差異有統計學意義。這與本研究結果存在差異,原因可能是由于兩個研究樣本量的不同所致。有關ON患者mIPL及mINL厚度丟失文獻報道較少。本研究結果發現,AQP4-Ab(+)ON組患眼mIPL丟失比AQP4-Ab(-)ON組患眼更嚴重,主要分布于黃斑的上方和下方。這可能與mIPL表達AQP4多相關。
血清AQP4-Ab在NMO患者的檢出率達到60%~90%,血清AQP4-Ab陽性對NMO診斷的特異性達到91%~100%[3, 16]。血清AQP4-Ab(+)ON患眼將來轉化為明確NMO的幾率極高。根據2007年Wingerchuk等[3]的診斷標準,已將其列入NMOSD范疇。本研究結果發現,AQP4-Ab(+)ON組患眼的pRNFL、mRNFL及mRGCL形態學損傷特點,與NMO性ON相同;pRNFL與mIPL損傷的程度及部位不同于AQP4-Ab(-)ON,可能能為判定ON轉化成NMO的風險提供結構學指標。但是本研究為橫斷面研究,視神經及黃斑部視網膜厚度個體差異較大;入組時兩組患者的病程未進行嚴格匹配。因此結果還有待于縱向、大樣本及影響因素嚴格控制的研究證實。
視神經脊髓炎(NMO)和多發性硬化(MS)是中樞神經系統(CNS)受累的自身免疫性脫髓鞘疾病,兩者常首先累及視神經,以視神經炎(ON)為首發癥狀而就診于眼科[1]。但兩者發病機制不同,NMO以B淋巴細胞介導的體液免疫為主,而MS以T淋巴細胞介導的免疫為主,故治療及預后亦不同[1, 2],因此早期準確診斷至關重要。視網膜神經纖維層(RNFL)到大腦枕葉皮質中樞的視覺通路是CNS的重要組成部分。RNFL具備CNS軸索特性,視網膜神經節細胞(RGC)具備CNS神經元的基本特征。所以采用光相干斷層掃描(OCT)技術觀察RGC、RNFL的變化可為判斷CNS神經元病變提供依據。水通道蛋白-4(AQP4)抗體(AQP4-Ab)陽性的ON患者與NMO臨床表現極其相似,轉化為NMO風險較高,稱為譜系疾病(NMOSD)[1, 3]。我們對一組ON患者進行了OCT檢查,對比觀察血清AQP4-Ab陽性ON[(AQP4-Ab(+)ON)]、血清AQP4-Ab陰性ON[(AQP4-Ab(-)ON)]患者以及正常對照者視盤RNFL厚度及黃斑區內層視網膜結構改變,以期尋找早期診斷NMOSD的結構性標志。現將結果報道如下。
1 對象和方法
2014年9月至2015年9月在解放軍總醫院眼科檢查確診的ON患者60例84只眼(ON組)納入研究。其中,男性16例25只眼,女性44例59只眼。年齡17~66歲,平均年齡(39.06±13.30)歲。病程≤6個月者42只眼,>6個月者42只眼。均行最佳矯正視力(BCVA)、眼前節、眼底及OCT檢查。
BCVA檢查為Snellen視力表,記錄時換算為最小分辨角對數(logMAR)視力。數指=logMAR1/41.85, 手動=logMAR1/42.3, 光感=logMAR1/42.7, 無光感=logMAR1/43.0[5]。檢查結果符合ON治療試驗診斷標準[4]。排除標準:(1)屈光度≥±6.00 DS,散光≥±2.00 DC;(2)視盤水腫;(3)既往有除ON以外的眼病或眼部手術史;(4)患有CNS疾病者。
根據血清AQP4-Ab檢查結果,將ON組分為AQP4-Ab(+)ON組、AQP4-Ab(-)ON組,均為30例42只眼。AQP4-Ab(+)ON組42只眼中,男性12只眼,女性30只眼;平均年齡(39.95±13.75)歲;病程≤6個月者19只眼,>6個月者23只眼;平均logMAR BCVA 0.98±0.93。AQP4-Ab(-)ON組42只眼中,男性13只眼,女性29只眼;平均年齡(38.17±12.94)歲;病程≤6個月者19只眼,>6個月者23只眼;平均logMAR BCVA 0.73±0.89。選取同期本院工作人員和與患者無血緣關系的家屬40名80只眼作為正常對照組(HC組)。其中,男性14名28只眼,女性26名52只眼;平均年齡(36.66±11.62)歲。視力、眼壓正常,無眼部疾病史。3組受檢者間性別(χ2=0.568)、年齡(χ2=1.472)比較,差異無統計學意義(P=0.732、0.732)。AQP4-Ab(-)ON組、AQP4-Ab(+)ON組間不同病程眼數(χ2=0.000)、平均logMAR BCVA(Z=-1.492)比較,差異無統計學意義(P=1.000、0.136)。
OCT檢查采用德國Heidelberg公司Spectralis-OCT儀行視盤及黃斑區掃描。應用標準視神經掃描模式(nisite)的盤周RNFL(pRNFL)程序,對盤周及其鼻側、鼻下、顳下、顳側、顳上、鼻上象限和盤斑束(PMB)RNFL厚度以及鼻側、顳側RNFL平均厚度比(N/T))進行分析。根據糖尿病視網膜病變早期治療研究制訂的標準[6],將黃斑部劃分為以黃斑中心凹為中心的3個同心圓, 分別為直徑1 mm的中心區,1 mm<直徑≤3 mm的內環區,3 mm<直徑≤6 mm的外環區;在內外環分別有2條放射線將其分為上下左右4區,共9個區(圖 1)。以A1代表中心區;A2、A3、A4、A5分別代表內環區的上方、顳側、下方、鼻側;A6、A7、A8、A9分別代表外環區的上方、顳側、下方、鼻側。應用黃斑程序對A1外其他8個分區的黃斑容積及黃斑部RNFL(mRNFL)、黃斑部RCG層(mRGCL)、黃斑部內叢狀層(mIPL)、黃斑部內核層(mINL)容積進行分析。
 圖1
黃斑部9個分區示意圖
圖1
黃斑部9個分區示意圖
采用SPSS 17.0統計學軟件進行統計分析處理。組間性別、病程比較行χ2檢驗;年齡比較行非參數檢驗的Kruskal-Walliss檢驗;logMAR BCVA比較行非參數Mann-Whitney檢驗。各組間均數比較采用兩兩比較的方差分析法或t檢驗,方差齊采用最小顯著差法,方差不齊采用Games-Howell法。P<0.05為差異有統計學意義。
2 結果
與HC組比較,ON組患眼總pRNFL平均厚度(圖 2)及視盤各象限、PMB平均RNFL厚度均明顯降低,差異有統學意義(P=0.000)。AQP4-Ab(+)ON組pRNFL平均厚度,視盤各象限、PMB平均RNFL厚度均較AQP4-Ab(-)ON組降低。其中,視盤鼻側及鼻下象限RNFL厚度差異有統計學意義(P=0.010、0.000)。兩組患眼間N/T差異有統計學意義(圖 3)。
 圖2
3組受檢眼pRNFL厚度比較。*P<0.05 ?圖 3 AQP4-Ab(+)ON組,AQP4-Ab(-)ON組患眼pRNFL厚度。與AQP4-Ab(-)ON組患眼比較,*P<0.01
圖2
3組受檢眼pRNFL厚度比較。*P<0.05 ?圖 3 AQP4-Ab(+)ON組,AQP4-Ab(-)ON組患眼pRNFL厚度。與AQP4-Ab(-)ON組患眼比較,*P<0.01
與HC組比較,ON組患眼黃斑容積及mRNFL、mRGCL、mIPL容積明顯減小,差異有統計學意義(P=0.000、0.000、0.000);mINL容積無明顯變化,差異無統計學意義(P=0.700)。AQP4-Ab(+)ON組患眼黃斑容積及mRNFL、mRGCL、mIPL容積較AQP4-Ab(-)ON組患眼減小,其中黃斑容積、mIPL容積減小程度差異有統計學意義(P=0.038、0.033)(圖 4)。與AQP4-Ab(-)ON組患眼比較,AQP4-Ab(+)ON組患眼外環下方區域黃斑平均容積,外環上方、下方區域mIPL平均容積,內環鼻側區域mRNFL平均容積減小更多,差異有統計學意義(P<0.05)(圖 5)。
 圖4
3組受檢眼黃斑容積、mRNFL容積、mRGCL容積、mIPL容積、mINL容積比較。4A~4E.分別為黃斑容積、mRNFL容積、mRGCL容積、mIPL容積、mINL容積。*P<0.05
圖4
3組受檢眼黃斑容積、mRNFL容積、mRGCL容積、mIPL容積、mINL容積比較。4A~4E.分別為黃斑容積、mRNFL容積、mRGCL容積、mIPL容積、mINL容積。*P<0.05
 圖5
AQP4-Ab(+)ON組、AQP4-Ab(-)ON組患眼黃斑各層損傷空間分布圖。5A~5E.分別為黃斑容積、mRNFL容積、mRGCL容積、mIPL容積、mINL容積。*與AQP4-Ab(-)ON組患眼比較,P<0.05
圖5
AQP4-Ab(+)ON組、AQP4-Ab(-)ON組患眼黃斑各層損傷空間分布圖。5A~5E.分別為黃斑容積、mRNFL容積、mRGCL容積、mIPL容積、mINL容積。*與AQP4-Ab(-)ON組患眼比較,P<0.05
3 討論
Ratchford等[7]對26例NMO-ON患者和378例MS患者進行觀察,發現前者pRNFL較后者更嚴重。首次ON發作后,NMO-ON患者pRNFL丟失比MS-ON患者多24 μm。由此作者提出,如果非MS患者發生ON后,pRNFL丟失大于15 μm,應該考慮NMO-ON可能性大。繼而Naismith等[8]采用OCT對22例NMO-ON患者和47例MS患者的pRNFL進行了測量,得到相同的結果。且發現首次ON發作后,pRNFL厚度每變薄1 μm,轉變成NMO的可能性就增加8%。Monteiro等[9]比較了45只MS-ON患眼和62只NMO-ON患眼,也發現pRNFL厚度的丟失,NMO-ON患眼比MS-ON患眼嚴重。與本研究AQP4-Ab(+)ON患眼pRNFL厚度比AQP4-Ab (-)ON患眼pRNFL厚度變薄結論相似。首次ON發作后,NMO-ON不但造成嚴重的pRNFL及視功能的丟失,而且對mRNFL損傷也較MS-ON重。Schneider等[10]對17例NMOSD-ON患者與17例MS-ON患者進行觀察,發現NMOSD-ON患者mRNFL丟失較MS-ON患者嚴重。Fernandes等[11]比較了29例NMO-ON患者與29例MS-ON患者的mRNFL容積,發現NMO-ON患者mRNFL厚度比MS-ON患者變薄,但差異無統計學意義。這些結果與本研究的結果基本相似,原因可能是因為NMO的發病機制與MS有所不同。NMO或NMOSD不僅造成神經纖維的脫髓鞘性損傷、而且造成神經壞死、空洞化[12];相比MS單一的脫髓鞘性改變,結構損傷也更重。另外Naismith等[8]研究還發現,NMO-ON患眼與MS-ON患眼相比,pRFNL厚度變薄在分布部位上也明顯不同。在兩組患眼對比視敏度無差異的情況下,NMO-ON患眼pRNFL丟失主要分布在上方、下方及鼻側。在Monteiro等[9]的研究中,也發現相同分分布特點。這一結果與本研究在控制視力損傷一致的情況下,AQP4-Ab(+)ON組患眼pRNFL的丟失主要分布于鼻側及下方的結果基本一致。這些特點可能與AQP4表達的分布有關。它主要表達在血管周圍星形膠質細胞的足突上,參與血腦屏障的形成。所以在視盤周圍上方、下方及鼻側,血管分布豐富的區域造成的神經損傷重,神經纖維丟失的也最明顯。
本研究發現,AQP4-Ab(+)ON組患眼在黃斑內環鼻側mRNFL平均容積丟失比AQP4-Ab(-)ON組患眼重。這種現象的機制尚不清楚,但這一結果或許能解釋NMO-ON比MS-ON患眼視力預后差的特點[10]。
尸體眼解剖發現,70%的MS患者出現RGC丟失[13, 14]。采用OCT觀察MS-ON及NMO-ON患眼的研究發現,mRGCL+mIPL厚度及黃斑厚度較正常眼明顯變薄[10, 15]。Kerrison等[13]研究發現,NMO-ON患眼的黃斑厚度比MS-ON丟失要更嚴重。這與本研究結果AQP4-Ab(+)ON組患眼比AQP4-Ab(-)ON組患眼黃斑容積丟失更重結果一致。Fernandes等[11]進一步分析了NMO-ON、MS-ON患眼mRGCL+mIPL厚度,發現NMO-ON患眼比MS-ON患眼變薄,但差異無統計學意義。與本研究AQP4-Ab(+)ON組患眼mRGCL容積丟失比AQP4-Ab(-)ON組多,但差別無統計學意義結果相一致。Schneider等[10]分析了NMO-ON患眼與MS-ON患眼mRGCL厚度變化情況,發現NMO-ON患眼比MS-ON患眼明顯變薄,差異有統計學意義。這與本研究結果存在差異,原因可能是由于兩個研究樣本量的不同所致。有關ON患者mIPL及mINL厚度丟失文獻報道較少。本研究結果發現,AQP4-Ab(+)ON組患眼mIPL丟失比AQP4-Ab(-)ON組患眼更嚴重,主要分布于黃斑的上方和下方。這可能與mIPL表達AQP4多相關。
血清AQP4-Ab在NMO患者的檢出率達到60%~90%,血清AQP4-Ab陽性對NMO診斷的特異性達到91%~100%[3, 16]。血清AQP4-Ab(+)ON患眼將來轉化為明確NMO的幾率極高。根據2007年Wingerchuk等[3]的診斷標準,已將其列入NMOSD范疇。本研究結果發現,AQP4-Ab(+)ON組患眼的pRNFL、mRNFL及mRGCL形態學損傷特點,與NMO性ON相同;pRNFL與mIPL損傷的程度及部位不同于AQP4-Ab(-)ON,可能能為判定ON轉化成NMO的風險提供結構學指標。但是本研究為橫斷面研究,視神經及黃斑部視網膜厚度個體差異較大;入組時兩組患者的病程未進行嚴格匹配。因此結果還有待于縱向、大樣本及影響因素嚴格控制的研究證實。