引用本文: 王穎, 江楓, 陳慶中, 張竹紅, 孟祥達, 顏華. 白介素10修飾的內皮祖細胞對糖尿病大鼠視網膜病變的影響. 中華眼底病雜志, 2015, 31(6): 575-580. doi: 10.3760/cma.j.issn.1005-1015.2015.06.016 復制
內皮祖細胞(EPC)是介于干細胞和血管內皮細胞之間,具有游走特性且能夠自我更新和增生分化的定向干細胞。我們的前期研究發現,輕中度非增生型糖尿病視網膜病變(DR)患者外周血EPC數量降低,增生型DR患者外周血EPC數量明顯增高[1];糖尿病患者外周血EPC不僅數量明顯下降,且其增生分化、遷移、黏附等細胞功能均發生改變,無法有效的發揮其正常功能[2]。白細胞介素(IL)10是一種重要免疫調節抑制因子,具有強烈的免疫系統調節作用。但在DR治療過程中,IL10對EPC的調節作用是否可以明顯改善EPC介導的視網膜血管修復目前尚不清楚。為此,我們觀察了IL10修飾的EPC對糖尿病大鼠視網膜病變的影響。現將結果報道如下。
1 材料和方法
1.1 EPC分離、培養、鑒定、分組及細胞培養液中相關因子濃度檢測
采用大鼠骨髓經密度梯度離心法分離單核細胞[3]。然后采用內皮細胞生長培養基-2(美國Lonza公司)重懸細胞,在37℃、5%CO2的細胞培養箱中培養。使用錐蟲藍染液檢測細胞活性,計算活細胞的百分率。活細胞百分率=活細胞數/總細胞數×100%。細胞培養至7 d時,采用免疫熒光細胞化學染色法鑒定EPC。熒光抗體分別為10μg/ml的Dil標記的乙酰低密度脂蛋白(Dil-acLDL,美國BD公司),異硫氰酸熒光素(FITC)標記的荊豆凝集素(FITC-UEA-1,美國Sigma公司),FITC標記的血管性血友病因子(FITC-vWF,1∶200,英國Abcam公司)和聚乙烯標記的血管內皮生長因子(VEGF)受體2(PE-VEGFR2,1∶100,上海研盟生物技術有限公司)。熒光倒置相差顯微鏡下(日本Olympus公司)觀察熒光染色的陽性細胞。
鑒定后取生長狀態良好的EPC,每孔加入10 μl慢病毒(LV)包裝的IL10-綠色熒光蛋白(GFP)質粒(EPC-LV-IL10-GFP組)或LV包裝的空白載體GFP質粒(EPC-LV-NC-GFP組),不加入任何質粒者作為EPC組。空白載體GFP質粒由西安科為生物技術有限公司提供。48~72 h后觀察細胞感染效率。感染融合率達到80%,作為后續實驗備用。
應用翔天試劑公司進口分裝大鼠腫瘤壞死因子(TNF)-α、IL10、IL8和VEGF成套試劑盒(靈敏度<0. 5 ng/L)。采用酶聯免疫吸附測定法(ELISA)和奧地利SPECTRA-Ⅲ型酶標儀檢測波長450 nm下的吸光度[A,舊稱光密度(OD)]值。根據不同濃度標準品所測的A450值繪制標準曲線。在標準曲線圖上根據每個待測樣本的A450值查找各因子相對應的濃度。
1.2 糖尿病動物模型建立及分組
雄性Wistar大鼠168只,體重200~220 g,天津醫科大學動物中心提供。均飼養于標準化動物中心且無特定病原體動物級動物房,自由攝食飲水。將大鼠分為正常對照組、糖尿病對照組、實驗對照組及實驗治療組,分別為28、28、56、56只。后3組大鼠腹腔注射鏈脲佐菌素溶液建立糖尿病模型;注射后48 h對大鼠行斷尾采血檢測空腹血糖,連續3次血糖濃度均在16.5 mmol/L以上,確認模型建立成功[4]。建模成功后3個月,實驗對照組、實驗治療組大鼠分別尾靜脈注射濃度為1×105/100 μl的EPC-LV-NC-GFP、EPC-LV-IL10-GFP;正常對照組、糖尿病對照組不給予任何干預。干預后1、2、4周,取材行相關實驗。
1.3 GFP表達、血視網膜屏障(BRB)破壞程度、視網膜病理組織學及細胞因子mRNA表達檢測
干預后2周過量麻醉處死大鼠共24只,摘取眼球制備石蠟切片。采用抗大鼠GFP(1∶250,英國Abcam公司)抗體行石蠟切片免疫組織化學染色,觀察GFP在視網膜各層的表達。
干預后2周10%水合氯醛腹腔注射麻醉大鼠共24只,以45 mg/kg的劑量尾靜脈注射3%伊凡思藍(EB)溶液。循環2 h后過量麻醉處死大鼠,摘取眼球于4%多聚甲醛溶液中固定2 h,在手術顯微鏡下剪開眼球去除眼前節;以視盤為中心將視網膜組織呈放射狀剪開,完整的將視網膜分離下來,平鋪于載玻片上,甘油封片,激光掃描共聚焦顯微鏡下觀察。
干預后1、2、4周10%水合氯醛腹腔注射麻醉大鼠共72只,鼠尾靜脈注射EB溶液體內循環2 h后,EB染色滲漏分析法[5]檢測大鼠視網膜血管滲漏性。分別檢測波長620、740 nm處的凈A值;建立EB染料濃度在甲酰胺中的標準曲線。根據EB與凈A值的關系,計算實際溶液中EB濃度。EB滲漏量(ng)=實際濃度×120 μl。用視網膜干重(mg)標化EB滲漏量(ng),結果表示為ng/mg。
干預后2周過量麻醉處死大鼠共24只,摘除眼球,制備電子顯微鏡超薄切片,H7650透射電子顯微鏡下觀察。
干預后2周過量麻醉處死大鼠共24只,摘除眼球,去除眼前節,剝離雙眼視網膜組織放入滅活RNA酶EP管中。采用Trizol法提取視網膜總RNA,ND-1000微量紫外可見分光光度計檢測RNA濃度。根據引物設計原則,由上海生工設計并合成針對大鼠的β-肌動蛋白(β-actin)、一氧化氮合酶(eNOS)、誘導型一氧化氮合酶(iNOS)、血管生成素(Ang)-1、VEGF及金屬蛋白酶(MMP)-9的特異性引物。配制聚合酶鏈反應(PCR)體系,將反應板放入7700型熒光定量逆轉錄PCR(RT-PCR)儀進行擴增。整理并分析數據,繪制柱狀圖。
1.4 統計學方法
采用SPSS 17.0統計軟件行統計學分析,數據用均數±標準差(
2 結果
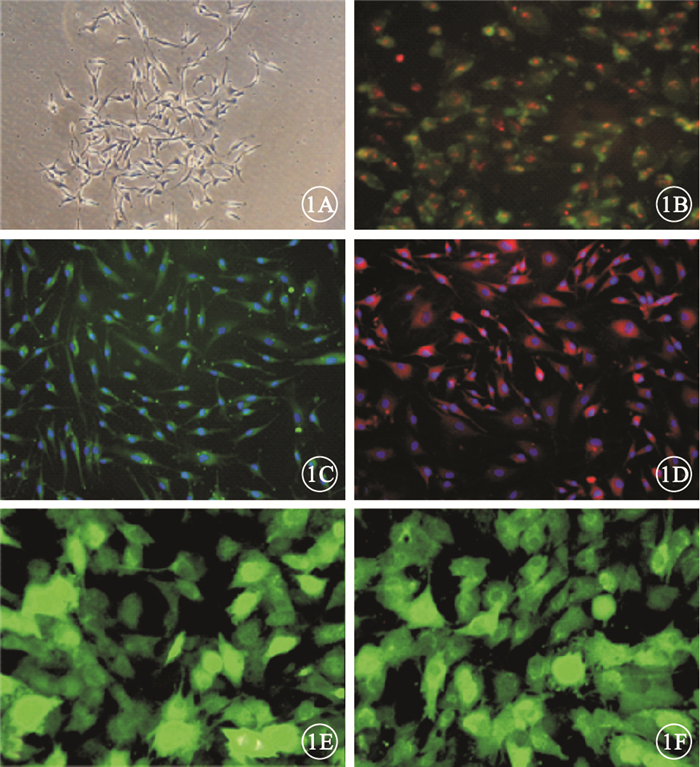
經密度梯度離心獲得的單個核細胞經錐蟲藍染色后活細胞百分率為(95.34±6.47)%。熒光顯微鏡觀察發現,細胞培養后3 d即可觀察到貼壁細胞的形態多為短梭型或多角形,呈集落狀生長(圖 1A);細胞培養至7 d結合Dil-acLDL后呈紅色熒光,結合FITC-UEA-1后呈綠色熒光,雙染色陽性細胞為黃色熒光(圖 1B)。經免疫熒光化學染色后,細胞表面抗原結合FITC-vWF后呈綠色熒光(圖 1C),細胞表面抗原結合PE-VEGFR2后呈紅色熒光(圖 1D)。染色細胞為正在分化的EPC。細胞感染48 h,EPC-LV-IL10-GFP組、EPC-LV-NC-GFP組細胞均表達GFP,呈綠色熒光(圖 1E,1F)。
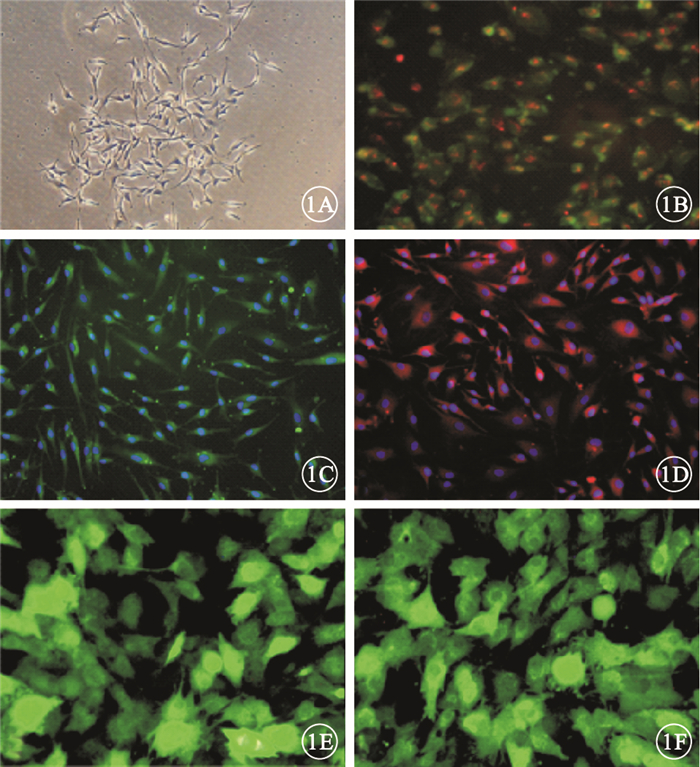 圖1
EPC熒光顯微鏡像。1A.培養的EPC形態多為短梭型或多角形,呈集落狀生長;1B.Dil-acLDL和FITC-UEA-1雙染色陽性細胞呈黃色熒光;1C.經免疫熒光化學染色后,細胞表面抗原結合FITC-vWF呈綠色熒光;1D.經免疫熒光化學染色后,細胞表面抗原結合PE-VEGFR2呈紅色熒光;1E.EPC-LV-IL10-GFP組細胞表達GFP,呈綠色熒光;1F.EPC-LV-NC-GFP組細胞表達GFP,呈綠色熒光×200
圖1
EPC熒光顯微鏡像。1A.培養的EPC形態多為短梭型或多角形,呈集落狀生長;1B.Dil-acLDL和FITC-UEA-1雙染色陽性細胞呈黃色熒光;1C.經免疫熒光化學染色后,細胞表面抗原結合FITC-vWF呈綠色熒光;1D.經免疫熒光化學染色后,細胞表面抗原結合PE-VEGFR2呈紅色熒光;1E.EPC-LV-IL10-GFP組細胞表達GFP,呈綠色熒光;1F.EPC-LV-NC-GFP組細胞表達GFP,呈綠色熒光×200
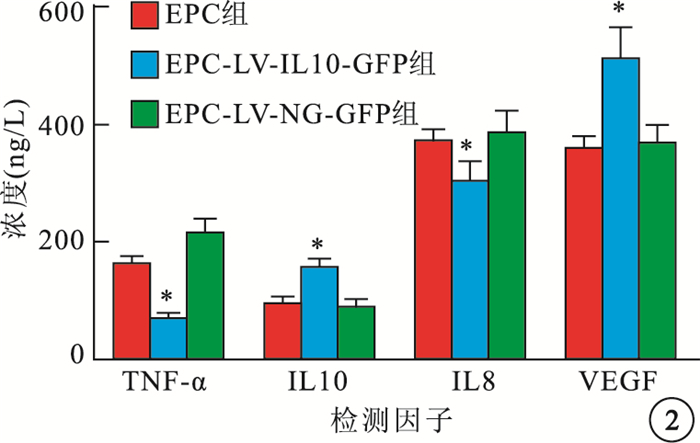
ELISA檢測結果顯示,EPC組、EPC-LV-IL10-GFP組和EPC-LV-NC-GFP組間細胞培養基中TNF-α、IL10、IL8和VEGF濃度比較,差異有統計學意義(F=28.910、14.242、10.795、26.097,P<0.05)。與EPC組、EPC-LV-NC-GFP組比較,EPC-LV-IL10-GFP組細胞培養基中TNF-α、IL8濃度明顯下降,差異有統計學意義(P<0.05);IL10、VEGF濃度明顯升高,差異有統計學意義(P<0.05)。EPC組與EPC-LV-NC-GFP組之間TNF-α、IL10、IL8、VEGF濃度比較,差異均無統計學意義(P>0.05)(圖 2)。
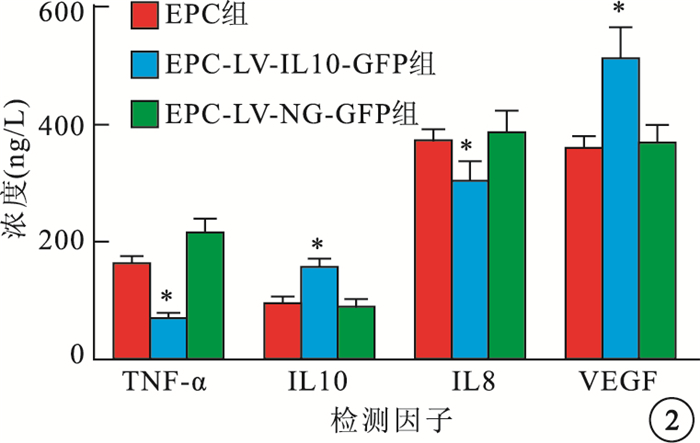 圖2
各組培養基中TNF-α、IL10、IL8和VEGF濃度比較。*EPC-LV-IL10-GFP組與EPC組、EPC-LV-NC-GFP組比較,P<0.05
圖2
各組培養基中TNF-α、IL10、IL8和VEGF濃度比較。*EPC-LV-IL10-GFP組與EPC組、EPC-LV-NC-GFP組比較,P<0.05
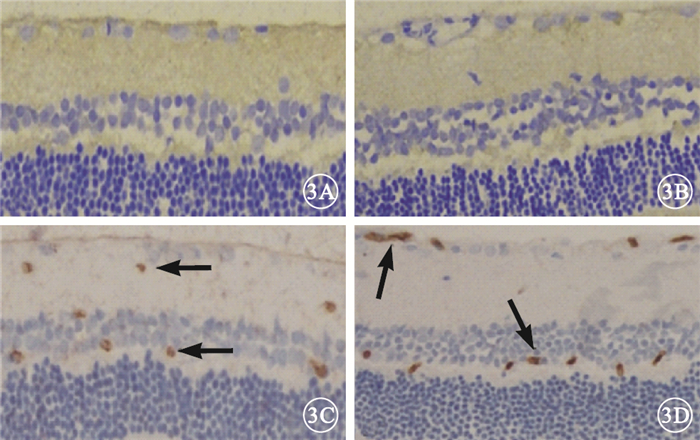
免疫組織化學染色結果顯示,正常對照組、糖尿病對照組大鼠視網膜組織GFP表達呈陰性(圖 3A,3B);干預后2周,實驗對照組、實驗治療組大鼠視網膜組織GFP表達呈陽性,主要表達在神經節細胞層、內核層及外叢狀層(圖 3C,3D)。
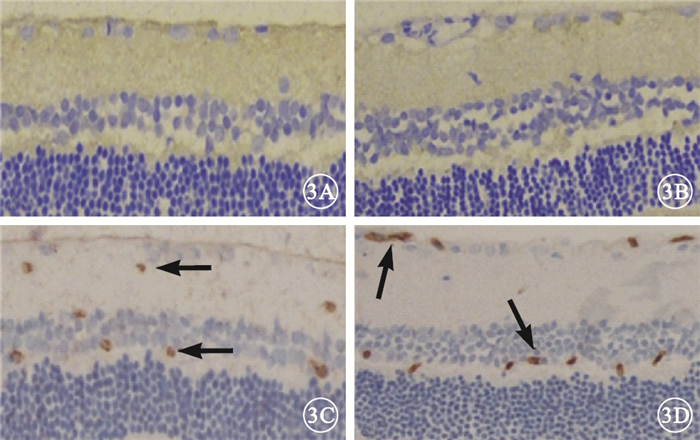 圖3
大鼠視網膜GFP免疫組織化學染色像。3A.正常對照組;3B.糖尿病對照組;3C.實驗對照組;3D.實驗治療組。正常對照組、糖尿病對照組大鼠視網膜組織GFP表達呈陰性;干預后2周,實驗對照組、實驗治療組大鼠視網膜組織GFP表達呈陽性(黑箭)免疫組織化學×200
圖3
大鼠視網膜GFP免疫組織化學染色像。3A.正常對照組;3B.糖尿病對照組;3C.實驗對照組;3D.實驗治療組。正常對照組、糖尿病對照組大鼠視網膜組織GFP表達呈陰性;干預后2周,實驗對照組、實驗治療組大鼠視網膜組織GFP表達呈陽性(黑箭)免疫組織化學×200
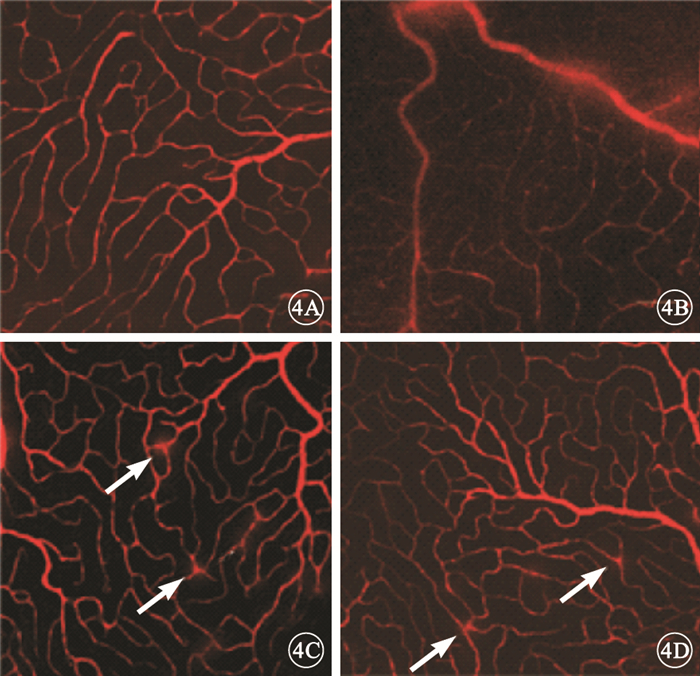
熒光顯微鏡觀察EB血管灌注造影視網膜鋪片,正常對照組大鼠視網膜血管結構清晰,未見熒光滲漏(圖 4A);糖尿病對照組大鼠視網膜血管彌漫性滲漏呈強熒光改變,局部血管紆曲、節段性擴張(圖 4B)。干預后2周,實驗對照組大鼠視網膜血管彌漫性滲漏較糖尿病對照組明顯減輕,血管輕度紆曲、擴張不明顯,但局部血管仍存在強熒光滲漏(圖 4C);實驗治療組大鼠視網膜血管彌漫性滲漏較實驗對照組明顯減輕,血管紆曲、擴張均不明顯,僅見血管局部呈強熒光滲漏(圖 4D)。
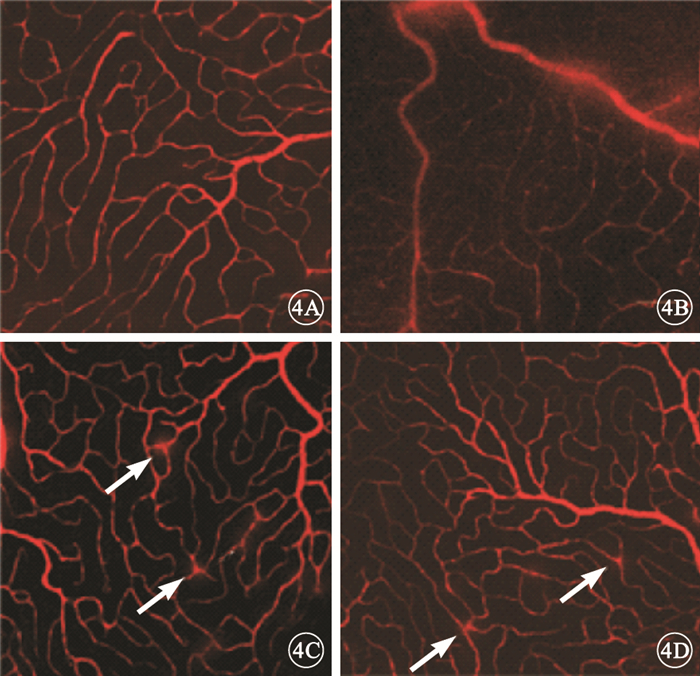 圖4
EB血管灌注造影視網膜鋪片熒光顯微鏡像。4A.正常對照組,視網膜血管無滲漏;4B.糖尿病對照組,視網膜血管彌漫性滲漏,呈強熒光改變,血管顯著紆曲擴張;4C.實驗對照組,視網膜血管輕度紆曲、局部血管存在強熒光滲漏(白箭);4D.實驗治療組,僅見視網膜血管局部呈強熒光滲漏(白箭)×200
圖4
EB血管灌注造影視網膜鋪片熒光顯微鏡像。4A.正常對照組,視網膜血管無滲漏;4B.糖尿病對照組,視網膜血管彌漫性滲漏,呈強熒光改變,血管顯著紆曲擴張;4C.實驗對照組,視網膜血管輕度紆曲、局部血管存在強熒光滲漏(白箭);4D.實驗治療組,僅見視網膜血管局部呈強熒光滲漏(白箭)×200
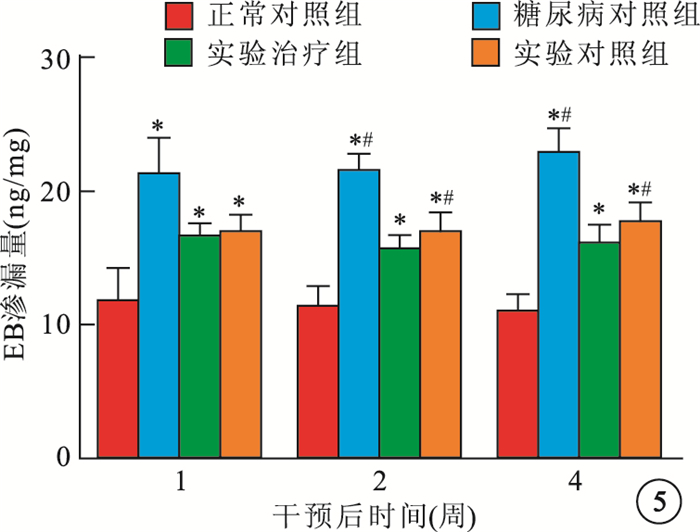
干預后1、2、4周,正常對照組、糖尿病對照組、實驗對照組、實驗治療組4組間大鼠視網膜組織EB平均滲漏量比較,差異均有統計學意義(F=35.316、95.734、101.608,P<0.05)。治療后1周各組大鼠視網膜組織EB平均滲漏量兩兩比較,糖尿病對照組較正常對照組明顯增高(P<0.05),實驗對照組、實驗治療組較糖尿病對照組明顯減弱(P<0.05),實驗對照組、實驗治療組之間無明顯差異(P>0.05)。治療后2、4周各組大鼠視網膜組織EB平均滲漏量兩兩比較,糖尿病對照組較正常對照組明顯增高(P<0.05),實驗對照組、實驗治療組較糖尿病對照組明顯減弱(P<0.05),實驗治療組較實驗對照組明顯減弱(P<0.05)(圖 5)。
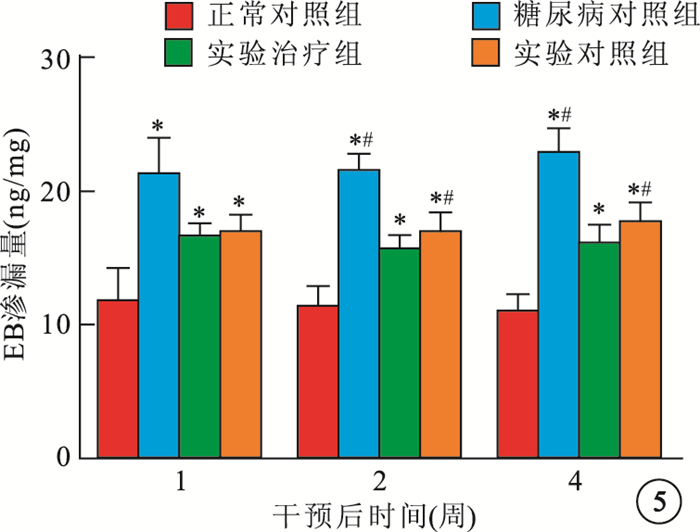 圖5
各組大鼠視網膜組織EB平均滲漏量比較。*與正常對照組比較,P<0.05;﹟與實驗治療組比較,P<0.05
圖5
各組大鼠視網膜組織EB平均滲漏量比較。*與正常對照組比較,P<0.05;﹟與實驗治療組比較,P<0.05
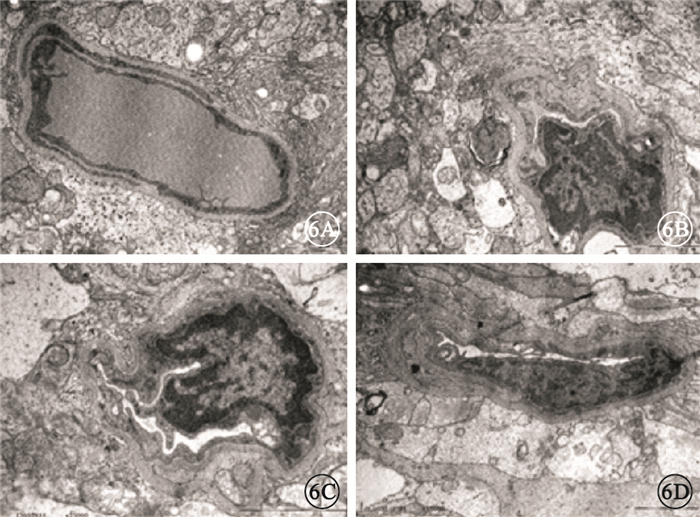
透射電子顯微鏡觀察發現,正常對照組大鼠視網膜毛細血管由內皮細胞、周細胞和基底膜共同構成,內皮細胞和周細胞內異染色質分布均勻,細胞器和細胞核的形態表現正常(圖 6A)。糖尿病對照組大鼠視網膜毛細血管基底膜增厚,血管壁結構不清晰,管腔狹窄幾乎閉塞,較大的血管內皮細胞增生并凸向管腔,內膜有斷裂,Bruch膜增寬,血管基底膜失去窗孔樣結構(圖 6B)。干預后2周,實驗對照組大鼠視網膜內管腔閉塞的小血管數量減少,管腔通暢的血管數量增多,部分小血管內體積很大的2個內皮細胞聚集在血管一端,薄的內膜與較厚的細胞質形成連接,細胞外基膜的形態不一致(圖 6C)。干預后2周,實驗治療組大鼠視網膜見干細胞分化的新血管,新生血管外有基膜包繞,Bruch膜處較大血管通暢,其血管內壁形成雙層,似有新的血管內皮細胞融合成為新的血管段(圖 6D)。
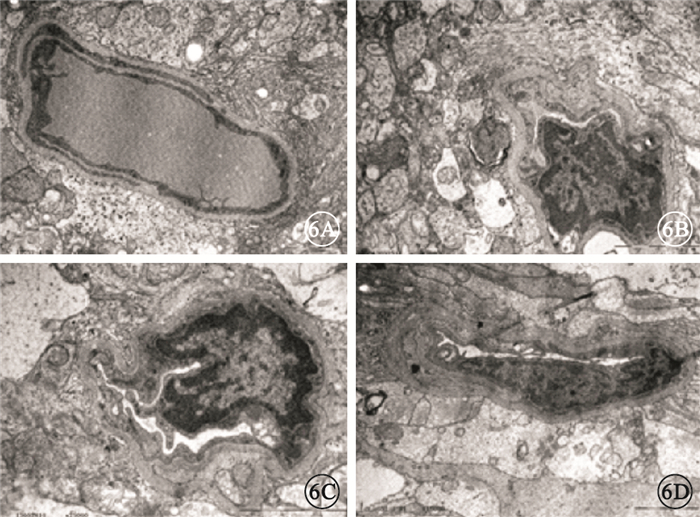 圖6
各組大鼠視網膜透射電子顯微鏡像。6A.正常對照組, 內皮細胞和周細胞內異染色質分布均勻,細胞器和細胞核的形態表現正常醋酸雙氧軸-枸櫞酸鉛×15 000;6B.糖尿病對照組,毛細血管基底膜增厚,管腔狹窄幾乎閉塞,血管內皮細胞增生并凸向管腔醋酸雙氧軸-枸櫞酸鉛×20 000;6C.實驗對照組,小血管薄的內膜與較厚的細胞質形成連接,細胞外基膜的形態不一致醋酸雙氧軸-枸櫞酸鉛×25 000;6D.實驗治療組,可見分化的新血管,新生血管外有基膜包繞,其血管內壁形成雙層醋酸雙氧軸-枸櫞酸鉛×15 000
圖6
各組大鼠視網膜透射電子顯微鏡像。6A.正常對照組, 內皮細胞和周細胞內異染色質分布均勻,細胞器和細胞核的形態表現正常醋酸雙氧軸-枸櫞酸鉛×15 000;6B.糖尿病對照組,毛細血管基底膜增厚,管腔狹窄幾乎閉塞,血管內皮細胞增生并凸向管腔醋酸雙氧軸-枸櫞酸鉛×20 000;6C.實驗對照組,小血管薄的內膜與較厚的細胞質形成連接,細胞外基膜的形態不一致醋酸雙氧軸-枸櫞酸鉛×25 000;6D.實驗治療組,可見分化的新血管,新生血管外有基膜包繞,其血管內壁形成雙層醋酸雙氧軸-枸櫞酸鉛×15 000
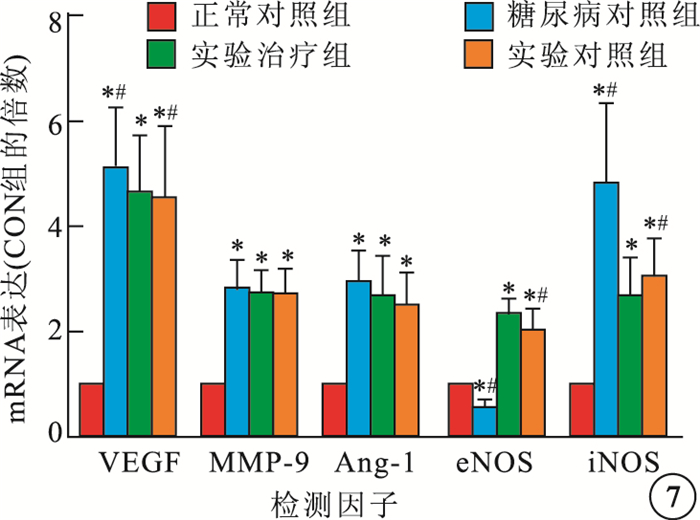
RT-PCR檢測結果顯示,正常對照組、糖尿病對照組、實驗對照組、實驗治療組4組間大鼠視網膜VEGF、MMP-9、Ang-1、eNOS、iNOS mRNA表達比較,差異均有統計學意義(F=30.029、32.479、20.577、88.903、27.477,P<0.05)。與正常對照組比較,糖尿病對照組大鼠視網膜VEGF、MMP-9、Ang-1、iNOS mRNA表達明顯提高(P<0.05),eNOS mRNA表達明顯降低(P<0.05)。與糖尿病對照組比較,實驗對照組、實驗治療組VEGF、iNOS mRNA表達明顯降低,且以實驗治療組降低更為明顯(P<0.05),Ang-1、MMP-9 mRNA表達無明顯變化(P>0.05),eNOS mRNA表達明顯提高(P<0.05)(圖 7)。
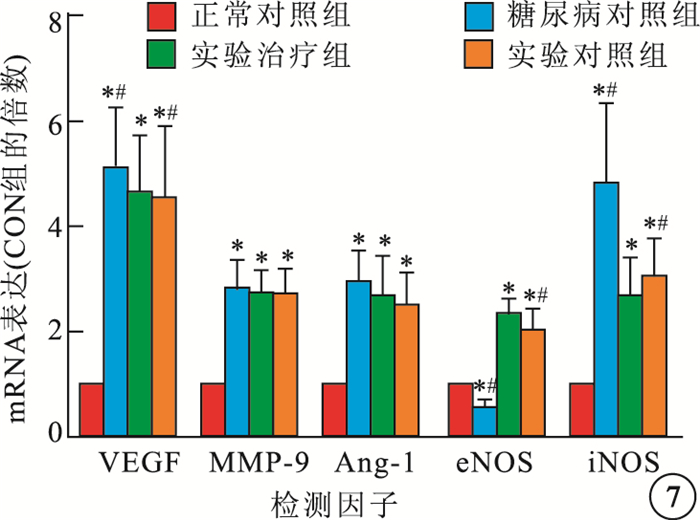 圖7
各組大鼠視網膜VEGF、MMP-9、Ang-1、eNOS、iNOS mRNA表達比較。*與正常對照組比較,P<0.05;﹟與實驗治療組比較,P<0.05
圖7
各組大鼠視網膜VEGF、MMP-9、Ang-1、eNOS、iNOS mRNA表達比較。*與正常對照組比較,P<0.05;﹟與實驗治療組比較,P<0.05
3 討論
目前普遍認為視網膜局部的炎性微環境是DR重要的發病機制之一。DR發生后,局部視網膜缺血缺氧、內皮細胞受損可促進多種促血管生成因子的異常表達;趨化外周血EPC參與血管修復和再生過程,從而消耗大量的EPC,導致其數量相對不足;同時DR炎性微環境下EPC功能降低,造成BRB損傷修復不足,DR病變逐步加重。已有研究表明,糖尿病患者外周血中EPC的數量較正常人減少約40%,且其增生、遷移、黏附能力均顯著降低[6]。EPC作為一種定向干細胞,具有良好的遷移能力和定位能力[7]。據此我們推測EPC可作為一種新型的基因載體應用于局部或全身。考慮到玻璃體腔注射的體積所限,一次移植的EPC數量有限,而反復注射又會增加眼內炎等嚴重并發癥的發生率;因此,我們采用大鼠尾靜脈注射,一次可以移植大量EPC且不會產生任何眼部并發癥。通過免疫組織化學染色方法觀察發現,實驗治療組及實驗對照組大鼠視網膜中GFP呈陽性表達,而正常對照組及糖尿病對照組大鼠視網膜中GFP呈陰性表達。表明外周血EPC可以通過BRB循環至視網膜,定向趨化并黏附于受損的血管上,原位分化為成熟的血管內皮細胞,參與新血管形成。
IL10是一種重要的免疫調節抑制因子,可以減輕局部組織炎癥反應并抑制多種促炎因子的產生。Krishnamurthy等[8]發現心肌損傷后,IL10對EPC的修復效果發揮了重要的調節作用。本研究結果表明,IL10修飾EPC后,細胞分泌IL10和VEGF增多,而TNF-α和IL8濃度降低。表明IL10可以調節局部炎癥因子,改善局部炎性微環境。體內實驗表明EPC植入大鼠體內后,實驗治療組和實驗對照組大鼠視網膜組織超微結構及血管滲漏情況均較糖尿病對照組好轉,尤其在實驗治療組中效果顯著。不同時間點EB定量檢測結果顯示,一次注射治療效果可維持4周。療效是否可以維持更久,還需要進一步研究。
本研究結果顯示,MMP-9和Ang-1在實驗對照組和實驗治療組中表達均升高。這是因為Ang-1不僅是重要的促血管生成因子,同時也是EPC重要的動員調節因子。增加外源性Ang-1可以使外周血EPC水平升高,此外Ang-1還可以抑制BRB的破壞,減少視網膜血管的損傷和死亡[9, 10]。而MMP-9是一種關鍵的促炎因子,可以通過多條作用途徑促進DR發生發展。但最近的研究發現,MMP-9在DR的發生發展過程中具有雙重作用。DR早期它可以破壞內皮細胞及周細胞的微血管結構,加速視網膜毛細血管細胞凋亡;DR晚期它可以促進血管新生[11]。因此我們認為,EPC通過上調MMP-9和Ang-1等促血管生成因子的表達,支持細胞分泌多種促血管形成的細胞因子,間接支持新血管的形成及受損內皮細胞的修復。
我們還發現,EPC治療可促進糖尿病大鼠視網膜eNOS表達并抑制iNOS表達。eNOS具有促進血管內皮細胞產生NO的作用,從而調節視網膜組織微循環,保持血管內皮細胞的完整性。而iNOS主要是在各種炎癥因子刺激下表達顯著增多,損害血管內皮細胞,增加血管通透性。有研究報道,糖尿病早期即發生eNOS水平降低和iNOS表達升高,抑制了血管內皮細胞釋放NO,引起血管擴張能力下降及管腔狹窄,從而加速DR的發生發展[12, 13]。因此我們推測,過表達IL10的EPC延緩DR病情發展,或許與其調節eNOS、iNOS的表達水平有關。
本研究結果表明,通過糖尿病大鼠尾靜脈注射IL10修飾EPC可以補充EPC數量,彌補DR發生后其數量相對不足的缺陷;同時還能改善糖尿病大鼠視網膜局部炎性微環境,支持細胞分泌多種促血管形成的細胞因子,間接促進新血管的形成及受損內皮細胞的修復,延緩DR的發展。這或許能為DR的治療開辟新的方向。
內皮祖細胞(EPC)是介于干細胞和血管內皮細胞之間,具有游走特性且能夠自我更新和增生分化的定向干細胞。我們的前期研究發現,輕中度非增生型糖尿病視網膜病變(DR)患者外周血EPC數量降低,增生型DR患者外周血EPC數量明顯增高[1];糖尿病患者外周血EPC不僅數量明顯下降,且其增生分化、遷移、黏附等細胞功能均發生改變,無法有效的發揮其正常功能[2]。白細胞介素(IL)10是一種重要免疫調節抑制因子,具有強烈的免疫系統調節作用。但在DR治療過程中,IL10對EPC的調節作用是否可以明顯改善EPC介導的視網膜血管修復目前尚不清楚。為此,我們觀察了IL10修飾的EPC對糖尿病大鼠視網膜病變的影響。現將結果報道如下。
1 材料和方法
1.1 EPC分離、培養、鑒定、分組及細胞培養液中相關因子濃度檢測
采用大鼠骨髓經密度梯度離心法分離單核細胞[3]。然后采用內皮細胞生長培養基-2(美國Lonza公司)重懸細胞,在37℃、5%CO2的細胞培養箱中培養。使用錐蟲藍染液檢測細胞活性,計算活細胞的百分率。活細胞百分率=活細胞數/總細胞數×100%。細胞培養至7 d時,采用免疫熒光細胞化學染色法鑒定EPC。熒光抗體分別為10μg/ml的Dil標記的乙酰低密度脂蛋白(Dil-acLDL,美國BD公司),異硫氰酸熒光素(FITC)標記的荊豆凝集素(FITC-UEA-1,美國Sigma公司),FITC標記的血管性血友病因子(FITC-vWF,1∶200,英國Abcam公司)和聚乙烯標記的血管內皮生長因子(VEGF)受體2(PE-VEGFR2,1∶100,上海研盟生物技術有限公司)。熒光倒置相差顯微鏡下(日本Olympus公司)觀察熒光染色的陽性細胞。
鑒定后取生長狀態良好的EPC,每孔加入10 μl慢病毒(LV)包裝的IL10-綠色熒光蛋白(GFP)質粒(EPC-LV-IL10-GFP組)或LV包裝的空白載體GFP質粒(EPC-LV-NC-GFP組),不加入任何質粒者作為EPC組。空白載體GFP質粒由西安科為生物技術有限公司提供。48~72 h后觀察細胞感染效率。感染融合率達到80%,作為后續實驗備用。
應用翔天試劑公司進口分裝大鼠腫瘤壞死因子(TNF)-α、IL10、IL8和VEGF成套試劑盒(靈敏度<0. 5 ng/L)。采用酶聯免疫吸附測定法(ELISA)和奧地利SPECTRA-Ⅲ型酶標儀檢測波長450 nm下的吸光度[A,舊稱光密度(OD)]值。根據不同濃度標準品所測的A450值繪制標準曲線。在標準曲線圖上根據每個待測樣本的A450值查找各因子相對應的濃度。
1.2 糖尿病動物模型建立及分組
雄性Wistar大鼠168只,體重200~220 g,天津醫科大學動物中心提供。均飼養于標準化動物中心且無特定病原體動物級動物房,自由攝食飲水。將大鼠分為正常對照組、糖尿病對照組、實驗對照組及實驗治療組,分別為28、28、56、56只。后3組大鼠腹腔注射鏈脲佐菌素溶液建立糖尿病模型;注射后48 h對大鼠行斷尾采血檢測空腹血糖,連續3次血糖濃度均在16.5 mmol/L以上,確認模型建立成功[4]。建模成功后3個月,實驗對照組、實驗治療組大鼠分別尾靜脈注射濃度為1×105/100 μl的EPC-LV-NC-GFP、EPC-LV-IL10-GFP;正常對照組、糖尿病對照組不給予任何干預。干預后1、2、4周,取材行相關實驗。
1.3 GFP表達、血視網膜屏障(BRB)破壞程度、視網膜病理組織學及細胞因子mRNA表達檢測
干預后2周過量麻醉處死大鼠共24只,摘取眼球制備石蠟切片。采用抗大鼠GFP(1∶250,英國Abcam公司)抗體行石蠟切片免疫組織化學染色,觀察GFP在視網膜各層的表達。
干預后2周10%水合氯醛腹腔注射麻醉大鼠共24只,以45 mg/kg的劑量尾靜脈注射3%伊凡思藍(EB)溶液。循環2 h后過量麻醉處死大鼠,摘取眼球于4%多聚甲醛溶液中固定2 h,在手術顯微鏡下剪開眼球去除眼前節;以視盤為中心將視網膜組織呈放射狀剪開,完整的將視網膜分離下來,平鋪于載玻片上,甘油封片,激光掃描共聚焦顯微鏡下觀察。
干預后1、2、4周10%水合氯醛腹腔注射麻醉大鼠共72只,鼠尾靜脈注射EB溶液體內循環2 h后,EB染色滲漏分析法[5]檢測大鼠視網膜血管滲漏性。分別檢測波長620、740 nm處的凈A值;建立EB染料濃度在甲酰胺中的標準曲線。根據EB與凈A值的關系,計算實際溶液中EB濃度。EB滲漏量(ng)=實際濃度×120 μl。用視網膜干重(mg)標化EB滲漏量(ng),結果表示為ng/mg。
干預后2周過量麻醉處死大鼠共24只,摘除眼球,制備電子顯微鏡超薄切片,H7650透射電子顯微鏡下觀察。
干預后2周過量麻醉處死大鼠共24只,摘除眼球,去除眼前節,剝離雙眼視網膜組織放入滅活RNA酶EP管中。采用Trizol法提取視網膜總RNA,ND-1000微量紫外可見分光光度計檢測RNA濃度。根據引物設計原則,由上海生工設計并合成針對大鼠的β-肌動蛋白(β-actin)、一氧化氮合酶(eNOS)、誘導型一氧化氮合酶(iNOS)、血管生成素(Ang)-1、VEGF及金屬蛋白酶(MMP)-9的特異性引物。配制聚合酶鏈反應(PCR)體系,將反應板放入7700型熒光定量逆轉錄PCR(RT-PCR)儀進行擴增。整理并分析數據,繪制柱狀圖。
1.4 統計學方法
采用SPSS 17.0統計軟件行統計學分析,數據用均數±標準差(
2 結果
經密度梯度離心獲得的單個核細胞經錐蟲藍染色后活細胞百分率為(95.34±6.47)%。熒光顯微鏡觀察發現,細胞培養后3 d即可觀察到貼壁細胞的形態多為短梭型或多角形,呈集落狀生長(圖 1A);細胞培養至7 d結合Dil-acLDL后呈紅色熒光,結合FITC-UEA-1后呈綠色熒光,雙染色陽性細胞為黃色熒光(圖 1B)。經免疫熒光化學染色后,細胞表面抗原結合FITC-vWF后呈綠色熒光(圖 1C),細胞表面抗原結合PE-VEGFR2后呈紅色熒光(圖 1D)。染色細胞為正在分化的EPC。細胞感染48 h,EPC-LV-IL10-GFP組、EPC-LV-NC-GFP組細胞均表達GFP,呈綠色熒光(圖 1E,1F)。
 圖1
EPC熒光顯微鏡像。1A.培養的EPC形態多為短梭型或多角形,呈集落狀生長;1B.Dil-acLDL和FITC-UEA-1雙染色陽性細胞呈黃色熒光;1C.經免疫熒光化學染色后,細胞表面抗原結合FITC-vWF呈綠色熒光;1D.經免疫熒光化學染色后,細胞表面抗原結合PE-VEGFR2呈紅色熒光;1E.EPC-LV-IL10-GFP組細胞表達GFP,呈綠色熒光;1F.EPC-LV-NC-GFP組細胞表達GFP,呈綠色熒光×200
圖1
EPC熒光顯微鏡像。1A.培養的EPC形態多為短梭型或多角形,呈集落狀生長;1B.Dil-acLDL和FITC-UEA-1雙染色陽性細胞呈黃色熒光;1C.經免疫熒光化學染色后,細胞表面抗原結合FITC-vWF呈綠色熒光;1D.經免疫熒光化學染色后,細胞表面抗原結合PE-VEGFR2呈紅色熒光;1E.EPC-LV-IL10-GFP組細胞表達GFP,呈綠色熒光;1F.EPC-LV-NC-GFP組細胞表達GFP,呈綠色熒光×200
ELISA檢測結果顯示,EPC組、EPC-LV-IL10-GFP組和EPC-LV-NC-GFP組間細胞培養基中TNF-α、IL10、IL8和VEGF濃度比較,差異有統計學意義(F=28.910、14.242、10.795、26.097,P<0.05)。與EPC組、EPC-LV-NC-GFP組比較,EPC-LV-IL10-GFP組細胞培養基中TNF-α、IL8濃度明顯下降,差異有統計學意義(P<0.05);IL10、VEGF濃度明顯升高,差異有統計學意義(P<0.05)。EPC組與EPC-LV-NC-GFP組之間TNF-α、IL10、IL8、VEGF濃度比較,差異均無統計學意義(P>0.05)(圖 2)。
 圖2
各組培養基中TNF-α、IL10、IL8和VEGF濃度比較。*EPC-LV-IL10-GFP組與EPC組、EPC-LV-NC-GFP組比較,P<0.05
圖2
各組培養基中TNF-α、IL10、IL8和VEGF濃度比較。*EPC-LV-IL10-GFP組與EPC組、EPC-LV-NC-GFP組比較,P<0.05
免疫組織化學染色結果顯示,正常對照組、糖尿病對照組大鼠視網膜組織GFP表達呈陰性(圖 3A,3B);干預后2周,實驗對照組、實驗治療組大鼠視網膜組織GFP表達呈陽性,主要表達在神經節細胞層、內核層及外叢狀層(圖 3C,3D)。
 圖3
大鼠視網膜GFP免疫組織化學染色像。3A.正常對照組;3B.糖尿病對照組;3C.實驗對照組;3D.實驗治療組。正常對照組、糖尿病對照組大鼠視網膜組織GFP表達呈陰性;干預后2周,實驗對照組、實驗治療組大鼠視網膜組織GFP表達呈陽性(黑箭)免疫組織化學×200
圖3
大鼠視網膜GFP免疫組織化學染色像。3A.正常對照組;3B.糖尿病對照組;3C.實驗對照組;3D.實驗治療組。正常對照組、糖尿病對照組大鼠視網膜組織GFP表達呈陰性;干預后2周,實驗對照組、實驗治療組大鼠視網膜組織GFP表達呈陽性(黑箭)免疫組織化學×200
熒光顯微鏡觀察EB血管灌注造影視網膜鋪片,正常對照組大鼠視網膜血管結構清晰,未見熒光滲漏(圖 4A);糖尿病對照組大鼠視網膜血管彌漫性滲漏呈強熒光改變,局部血管紆曲、節段性擴張(圖 4B)。干預后2周,實驗對照組大鼠視網膜血管彌漫性滲漏較糖尿病對照組明顯減輕,血管輕度紆曲、擴張不明顯,但局部血管仍存在強熒光滲漏(圖 4C);實驗治療組大鼠視網膜血管彌漫性滲漏較實驗對照組明顯減輕,血管紆曲、擴張均不明顯,僅見血管局部呈強熒光滲漏(圖 4D)。
 圖4
EB血管灌注造影視網膜鋪片熒光顯微鏡像。4A.正常對照組,視網膜血管無滲漏;4B.糖尿病對照組,視網膜血管彌漫性滲漏,呈強熒光改變,血管顯著紆曲擴張;4C.實驗對照組,視網膜血管輕度紆曲、局部血管存在強熒光滲漏(白箭);4D.實驗治療組,僅見視網膜血管局部呈強熒光滲漏(白箭)×200
圖4
EB血管灌注造影視網膜鋪片熒光顯微鏡像。4A.正常對照組,視網膜血管無滲漏;4B.糖尿病對照組,視網膜血管彌漫性滲漏,呈強熒光改變,血管顯著紆曲擴張;4C.實驗對照組,視網膜血管輕度紆曲、局部血管存在強熒光滲漏(白箭);4D.實驗治療組,僅見視網膜血管局部呈強熒光滲漏(白箭)×200
干預后1、2、4周,正常對照組、糖尿病對照組、實驗對照組、實驗治療組4組間大鼠視網膜組織EB平均滲漏量比較,差異均有統計學意義(F=35.316、95.734、101.608,P<0.05)。治療后1周各組大鼠視網膜組織EB平均滲漏量兩兩比較,糖尿病對照組較正常對照組明顯增高(P<0.05),實驗對照組、實驗治療組較糖尿病對照組明顯減弱(P<0.05),實驗對照組、實驗治療組之間無明顯差異(P>0.05)。治療后2、4周各組大鼠視網膜組織EB平均滲漏量兩兩比較,糖尿病對照組較正常對照組明顯增高(P<0.05),實驗對照組、實驗治療組較糖尿病對照組明顯減弱(P<0.05),實驗治療組較實驗對照組明顯減弱(P<0.05)(圖 5)。
 圖5
各組大鼠視網膜組織EB平均滲漏量比較。*與正常對照組比較,P<0.05;﹟與實驗治療組比較,P<0.05
圖5
各組大鼠視網膜組織EB平均滲漏量比較。*與正常對照組比較,P<0.05;﹟與實驗治療組比較,P<0.05
透射電子顯微鏡觀察發現,正常對照組大鼠視網膜毛細血管由內皮細胞、周細胞和基底膜共同構成,內皮細胞和周細胞內異染色質分布均勻,細胞器和細胞核的形態表現正常(圖 6A)。糖尿病對照組大鼠視網膜毛細血管基底膜增厚,血管壁結構不清晰,管腔狹窄幾乎閉塞,較大的血管內皮細胞增生并凸向管腔,內膜有斷裂,Bruch膜增寬,血管基底膜失去窗孔樣結構(圖 6B)。干預后2周,實驗對照組大鼠視網膜內管腔閉塞的小血管數量減少,管腔通暢的血管數量增多,部分小血管內體積很大的2個內皮細胞聚集在血管一端,薄的內膜與較厚的細胞質形成連接,細胞外基膜的形態不一致(圖 6C)。干預后2周,實驗治療組大鼠視網膜見干細胞分化的新血管,新生血管外有基膜包繞,Bruch膜處較大血管通暢,其血管內壁形成雙層,似有新的血管內皮細胞融合成為新的血管段(圖 6D)。
 圖6
各組大鼠視網膜透射電子顯微鏡像。6A.正常對照組, 內皮細胞和周細胞內異染色質分布均勻,細胞器和細胞核的形態表現正常醋酸雙氧軸-枸櫞酸鉛×15 000;6B.糖尿病對照組,毛細血管基底膜增厚,管腔狹窄幾乎閉塞,血管內皮細胞增生并凸向管腔醋酸雙氧軸-枸櫞酸鉛×20 000;6C.實驗對照組,小血管薄的內膜與較厚的細胞質形成連接,細胞外基膜的形態不一致醋酸雙氧軸-枸櫞酸鉛×25 000;6D.實驗治療組,可見分化的新血管,新生血管外有基膜包繞,其血管內壁形成雙層醋酸雙氧軸-枸櫞酸鉛×15 000
圖6
各組大鼠視網膜透射電子顯微鏡像。6A.正常對照組, 內皮細胞和周細胞內異染色質分布均勻,細胞器和細胞核的形態表現正常醋酸雙氧軸-枸櫞酸鉛×15 000;6B.糖尿病對照組,毛細血管基底膜增厚,管腔狹窄幾乎閉塞,血管內皮細胞增生并凸向管腔醋酸雙氧軸-枸櫞酸鉛×20 000;6C.實驗對照組,小血管薄的內膜與較厚的細胞質形成連接,細胞外基膜的形態不一致醋酸雙氧軸-枸櫞酸鉛×25 000;6D.實驗治療組,可見分化的新血管,新生血管外有基膜包繞,其血管內壁形成雙層醋酸雙氧軸-枸櫞酸鉛×15 000
RT-PCR檢測結果顯示,正常對照組、糖尿病對照組、實驗對照組、實驗治療組4組間大鼠視網膜VEGF、MMP-9、Ang-1、eNOS、iNOS mRNA表達比較,差異均有統計學意義(F=30.029、32.479、20.577、88.903、27.477,P<0.05)。與正常對照組比較,糖尿病對照組大鼠視網膜VEGF、MMP-9、Ang-1、iNOS mRNA表達明顯提高(P<0.05),eNOS mRNA表達明顯降低(P<0.05)。與糖尿病對照組比較,實驗對照組、實驗治療組VEGF、iNOS mRNA表達明顯降低,且以實驗治療組降低更為明顯(P<0.05),Ang-1、MMP-9 mRNA表達無明顯變化(P>0.05),eNOS mRNA表達明顯提高(P<0.05)(圖 7)。
 圖7
各組大鼠視網膜VEGF、MMP-9、Ang-1、eNOS、iNOS mRNA表達比較。*與正常對照組比較,P<0.05;﹟與實驗治療組比較,P<0.05
圖7
各組大鼠視網膜VEGF、MMP-9、Ang-1、eNOS、iNOS mRNA表達比較。*與正常對照組比較,P<0.05;﹟與實驗治療組比較,P<0.05
3 討論
目前普遍認為視網膜局部的炎性微環境是DR重要的發病機制之一。DR發生后,局部視網膜缺血缺氧、內皮細胞受損可促進多種促血管生成因子的異常表達;趨化外周血EPC參與血管修復和再生過程,從而消耗大量的EPC,導致其數量相對不足;同時DR炎性微環境下EPC功能降低,造成BRB損傷修復不足,DR病變逐步加重。已有研究表明,糖尿病患者外周血中EPC的數量較正常人減少約40%,且其增生、遷移、黏附能力均顯著降低[6]。EPC作為一種定向干細胞,具有良好的遷移能力和定位能力[7]。據此我們推測EPC可作為一種新型的基因載體應用于局部或全身。考慮到玻璃體腔注射的體積所限,一次移植的EPC數量有限,而反復注射又會增加眼內炎等嚴重并發癥的發生率;因此,我們采用大鼠尾靜脈注射,一次可以移植大量EPC且不會產生任何眼部并發癥。通過免疫組織化學染色方法觀察發現,實驗治療組及實驗對照組大鼠視網膜中GFP呈陽性表達,而正常對照組及糖尿病對照組大鼠視網膜中GFP呈陰性表達。表明外周血EPC可以通過BRB循環至視網膜,定向趨化并黏附于受損的血管上,原位分化為成熟的血管內皮細胞,參與新血管形成。
IL10是一種重要的免疫調節抑制因子,可以減輕局部組織炎癥反應并抑制多種促炎因子的產生。Krishnamurthy等[8]發現心肌損傷后,IL10對EPC的修復效果發揮了重要的調節作用。本研究結果表明,IL10修飾EPC后,細胞分泌IL10和VEGF增多,而TNF-α和IL8濃度降低。表明IL10可以調節局部炎癥因子,改善局部炎性微環境。體內實驗表明EPC植入大鼠體內后,實驗治療組和實驗對照組大鼠視網膜組織超微結構及血管滲漏情況均較糖尿病對照組好轉,尤其在實驗治療組中效果顯著。不同時間點EB定量檢測結果顯示,一次注射治療效果可維持4周。療效是否可以維持更久,還需要進一步研究。
本研究結果顯示,MMP-9和Ang-1在實驗對照組和實驗治療組中表達均升高。這是因為Ang-1不僅是重要的促血管生成因子,同時也是EPC重要的動員調節因子。增加外源性Ang-1可以使外周血EPC水平升高,此外Ang-1還可以抑制BRB的破壞,減少視網膜血管的損傷和死亡[9, 10]。而MMP-9是一種關鍵的促炎因子,可以通過多條作用途徑促進DR發生發展。但最近的研究發現,MMP-9在DR的發生發展過程中具有雙重作用。DR早期它可以破壞內皮細胞及周細胞的微血管結構,加速視網膜毛細血管細胞凋亡;DR晚期它可以促進血管新生[11]。因此我們認為,EPC通過上調MMP-9和Ang-1等促血管生成因子的表達,支持細胞分泌多種促血管形成的細胞因子,間接支持新血管的形成及受損內皮細胞的修復。
我們還發現,EPC治療可促進糖尿病大鼠視網膜eNOS表達并抑制iNOS表達。eNOS具有促進血管內皮細胞產生NO的作用,從而調節視網膜組織微循環,保持血管內皮細胞的完整性。而iNOS主要是在各種炎癥因子刺激下表達顯著增多,損害血管內皮細胞,增加血管通透性。有研究報道,糖尿病早期即發生eNOS水平降低和iNOS表達升高,抑制了血管內皮細胞釋放NO,引起血管擴張能力下降及管腔狹窄,從而加速DR的發生發展[12, 13]。因此我們推測,過表達IL10的EPC延緩DR病情發展,或許與其調節eNOS、iNOS的表達水平有關。
本研究結果表明,通過糖尿病大鼠尾靜脈注射IL10修飾EPC可以補充EPC數量,彌補DR發生后其數量相對不足的缺陷;同時還能改善糖尿病大鼠視網膜局部炎性微環境,支持細胞分泌多種促血管形成的細胞因子,間接促進新血管的形成及受損內皮細胞的修復,延緩DR的發展。這或許能為DR的治療開辟新的方向。