引用本文: 段紅濤, 陳松, 董蒙, 王月欣, 孔佳慧, 宋建, 李澤東, 王繼明. 慢病毒載體介導色素上皮衍生因子基因轉染人臍帶間充質干細胞研究. 中華眼底病雜志, 2017, 33(6): 621-625. doi: 10.3760/cma.j.issn.1005-1015.2017.06.016 復制
間充質干細胞(MSCs)是一種具有自我更新、多向分化潛能的干細胞,因其免疫原性極低,性能穩定,易于獲得和擴增;不同來源MSCs已應用于多種視網膜相關疾病的研究[1]。色素上皮衍生因子(PEDF)是一種多功能因子,具有營養作用和多種生物活性,如抗血管生成、抗增生、促分化、抗炎和抗腫瘤等[2-4]。但因其半衰期短,應用受到限制。本研究將PEDF基因導入人臍帶MSCs(hUCMSCs)中,使得hUCMSCs高表達PEDF。初步探討基因修飾的hUCMSCs(PEDF-MSCs)的可行性與安全性,為PEDF-MSCs在眼部新生血管類疾病研究提供實驗基礎。現將結果報道如下。
1 材料和方法
1.1 材料
原代hUCMSCs由中國醫學科學院血液學研究所泰達生命科學技術研究中心惠贈。抗原分化簇(CD)(美國BD公司);聚凝胺(polybrene)(美國Santa Cruze公司);總RNA提取試劑盒(中國北京賽百盛基因技術有限公司);dNTP(美國Invitrogen公司);聚合酶鏈反應(PCR)引物(中國北京奧科生物技術有限公司);SYBR Premix Ex Taq Ⅰ(日本Takara公司);RNA酶抑制劑(日本Takara公司);DNA marker、DNA marker DL2000(日本Takara公司);Taq DNA聚合酶(日本Takara公司);寡聚胸苷酸引物(日本Takara公司);莫洛尼鼠白血病病毒cDNA合成試劑盒(美國Invitrogen公司);熒光倒置顯微鏡(日本Olympus公司);熒光定量PCR儀(德國Eppendorf公司);酶標儀(美國Thermo公司)。
1.2 hUCMSCs培養與免疫表型檢測
原代hUCMSCs置于T75 cm2培養瓶傳代培養,加入含10% 胎牛血清(FBS)、100 μg/ml青霉素、100 μg/ml鏈霉素的DF12完全培養基15 ml。置于37℃,飽和濕度,含5% CO2細胞培養箱中培養,貼壁生長至80%~90%融合時,根據需求按照1:2或1:3進行傳代,純化細胞,取4~6代細胞用于實驗。倒置顯微鏡下觀察細胞形態變化。
取第5代細胞,經0.25%胰蛋白酶或0.01%乙二胺四乙酸消化液消化分散為單個細胞,磷酸鹽緩沖鹽溶液(PBS)反復吹打沖洗,4500 r/min離心3 min,棄上清液。流式管中分別加入鼠抗人異硫氰酸熒光素(FITC)標記的CD19、CD34和鼠抗人藻紅蛋白(PE)標記的CD73、CD105、CD11b、CD45、CD90、HLA-DR (HLA-Ⅱ),同型對照管加入抗小鼠抗體IgG1-PE和IgG1-FITC;4 ℃避光孵育30 min,PBS沖洗后1%多聚甲醛(PFA)固定。流式細胞儀檢測分析細胞免疫表型。
1.3 構建PEDF重組慢病毒(LV)載體
從Genebank查取構建的基因信息: Homo sapiens PEDF, NCBI reference sequence: NM_002615;OEF sequence: 1257 堿基對(bp)。上游引物5′-ACCTCTAGAATGCAGGCCCTGGTGCTACTCC-3′,下游引物5′-CACGCGGCCGCTTAGGGGCCCCTGGGGTCCAGA-3′,并在兩端分別引入XbaⅠ和NotⅠ酶切位點(下劃線標出)及保護堿基,PCR擴增PEDF基因片段開放閱讀框全長;擴增產物經瓊脂糖凝膠電泳分離,DNA凝膠回收試劑盒回收,克隆入pGEM-T easy載體;再轉化大腸桿菌感受態細胞,接種在氨芐霉素抗性平板上,16 h后挑取經藍白斑篩選的陽性克隆,置于Luria-Bertani液體培養基,37 ℃振蕩培養18 h,菌落PCR鑒定的陽性克隆用Qiagen質粒小提試劑盒提取質粒,并測序驗證;驗證正確的克隆用XbaⅠ和NotⅠ雙酶切后與經同樣雙酶切的攜帶綠色熒光蛋白(GFP)基因的LV載體pCDH-CMV-MCS-EF1-copGFP相連接,構建PEDF-GFP共表達載體。以pCDH-CMV-MCS-EF1-copGFP載體作為對照。病毒滴度的測定通過將病毒稀釋成不同濃度浸染293T細胞,通過檢測不同稀釋倍數的病毒感染293細胞的效率計算病毒滴度,轉染前將病毒滴度調整為5×108 TU/ml備用。
1.4 PEDF重組LV載體轉染hUCMSCs及轉染效率
將培養的hUCMSCs接種到6孔板,待其融合度約為50%~70%時,吸取原有培養基,加入新鮮的Dulbecco改良Eagle培養基/F12培養基,每孔2 ml。每孔加入1 μl polybrene, 放入培養箱孵育30 min。細胞長至約50%融合時,以感染復數(MOI)值為10、30、50的PEDF基因重組LV載體(LV-PEDF-GFP)分別轉染3孔細胞(10MOI實驗組、30MOI實驗組、50MOI實驗組),其余3孔細胞為相應MOI對照組,用不含PEDF基因的相同MOI值的重組LV載體(LV-GFP)進行轉染。混勻后,37 ℃培養箱孵育12 h。12 h后吸取含病毒的培養基,更換為新鮮培養基,37℃培養箱繼續培養。各組細胞轉染后48、72、96 h熒光顯微鏡觀察細胞GFP表達。
將無菌細胞爬片置于6孔板,加入細胞懸液,37 ℃,24 h,PBS沖洗2次,4% PFA固定20 min,PBS沖洗2次,加入0.2% 聚乙二醇辛基苯基醚(triton-100),室溫避光,10 min,PBS沖洗2次,滴加二脒基苯基吲哚(DAPI),染色5 min。PBS沖洗2次,50%甘油固定。熒光顯微鏡下轉染成功的細胞胞漿呈綠色,以此計數轉染效率;分別選取5個視野,計算平均值。
1.5 免疫熒光檢測細胞PEDF、VEGF表達
選取LV-PEDF-GFP、LV-GFP轉染后72、96 h 50MOI實驗組、50MOI對照組細胞,平鋪于含有細胞爬片的24孔板中,細胞濃度5×104/ml,冰PBS終止刺激,4% PFA固定10 min,PBS沖洗3次,加入0.2% triton-100室溫避光10 min;PBS沖洗3次,加入1 ml 3% 牛血清白蛋白室溫封閉1 h;PBS沖洗1次,加入一抗PEDF(1:100)、VEGF(1:100),4 ℃過夜;PBS沖洗3次,加入二抗(1:100),避光,室溫孵育1 h;PBS沖洗3次,加入DAPI染核(1:1 000),避光室溫10 min;PBS沖洗2次,將爬片移至載玻片上,50%甘油封閉。實驗重復3次。熒光顯微鏡觀察。紅色為TRIC標記的陽性細胞,藍色為DAPI細胞核染色。
1.6 免疫細胞化學法檢測hUCMSCs中PEDF、VEGF表達
選取轉染后96 h的50MOI對照組、50MOI實驗組細胞爬片,方法同免疫熒光檢測。鏈霉菌抗生物素蛋白-過氧化物酶連結(SP)法行免疫細胞化學染色,二氨基聯苯胺(DAB)顯色,陽性細胞表達棕色;細胞核蘇木精復染。光學顯微鏡下觀察。
1.7 實時定量PCR(RT-PCR)檢測MOI50實驗組、MOI50對照組細胞中PEDF、VEGF mRNA表達
采用primer premier 5.0和Oligo 6.0 軟件設計特異性引物。PEDF,上游引物:5′-TTCACCCGGAGCAGTGAT-3′, 下游引物: 5′-GCCTCCAGAATTGTGTTTGAG-3′;VEGF,上游引物: 5′-CTATGCAGATCATGCGGATCA-3′, 下游引物: 5′-TATGCTGCAGGAAGCTCATCTC-3′。擴增條件預變性95 ℃ 15 s,變性95 ℃ 15 s,退火57 ℃ 30 s,延伸74 ℃ 30 s,保存4 ℃,45個循環。反應結束后,根據測得的樣品Ct值,以2?△△Ct表示目的基因mRNA相對表達值。以β-肌動蛋白(actin)為內參照,每份模板的每個基因重復3次檢測。應用2?△△CT法進行數據處理,計算各標本目的基因相對于對照組某一標本的相對表達量。
1.8 統計學方法
采用SPSS 19.0統計學軟件行統計分析。各組數據以均數±標準差(
 )表示。正態概率圖顯示各組數據呈近似正態分布,方差齊性檢驗顯示方差齊,組間比較行獨立樣本t檢驗。P<0.05為差異有統計學意義。
)表示。正態概率圖顯示各組數據呈近似正態分布,方差齊性檢驗顯示方差齊,組間比較行獨立樣本t檢驗。P<0.05為差異有統計學意義。
2 結果
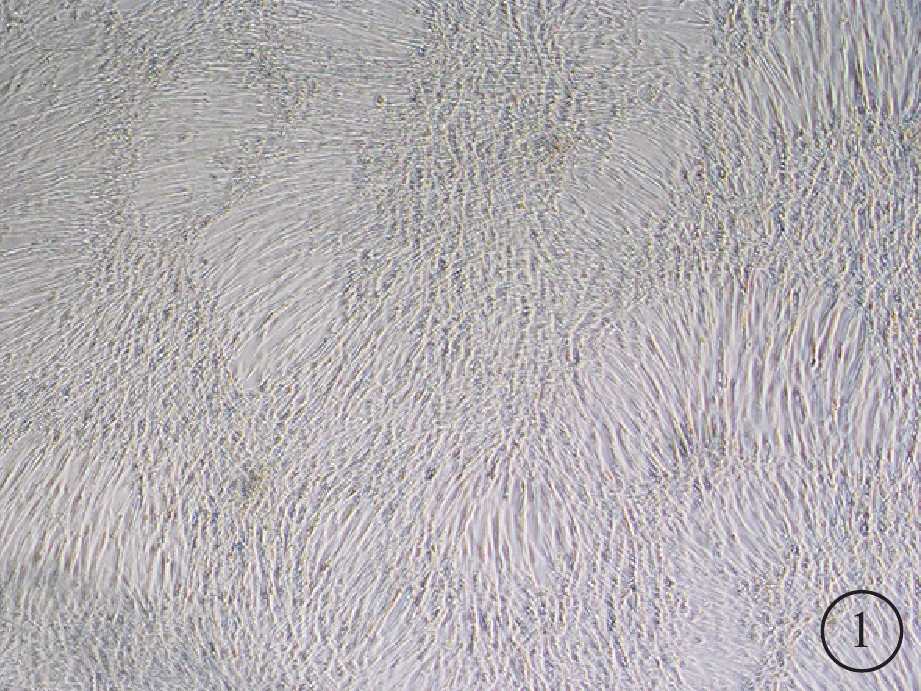
倒置顯微鏡觀察發現,hUCMSCs培養4~5 h后部分開始貼壁生長,呈短梭形,散在分布;未貼壁細胞為圓形。5~7 d后可見細胞呈長梭形,80%~90%融合,形態相對均一,呈漩渦狀排列(圖1)。流式細胞儀測定結果顯示,CD105(SH2)、CD73(SH3)、CD90陽性率95%以上;CD34、CD45、CD11b、CD19和HLA-DR(HLA-Ⅱ)陽性率低于2%。
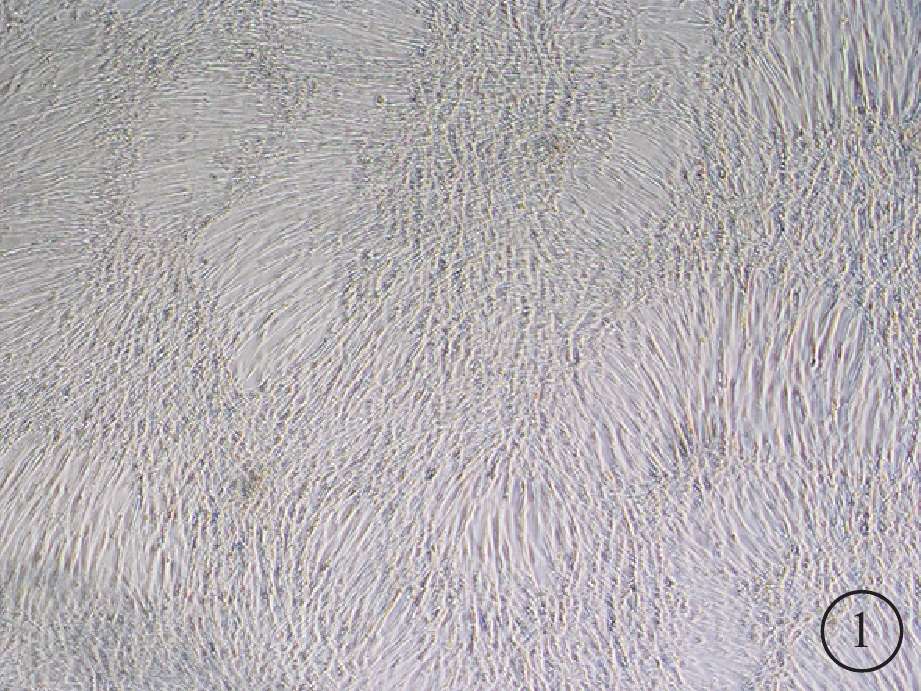 圖1
hUCMSCs光學顯微鏡像。培養的hUCMSCs呈長梭形生長,漩渦狀排列。×40
圖1
hUCMSCs光學顯微鏡像。培養的hUCMSCs呈長梭形生長,漩渦狀排列。×40
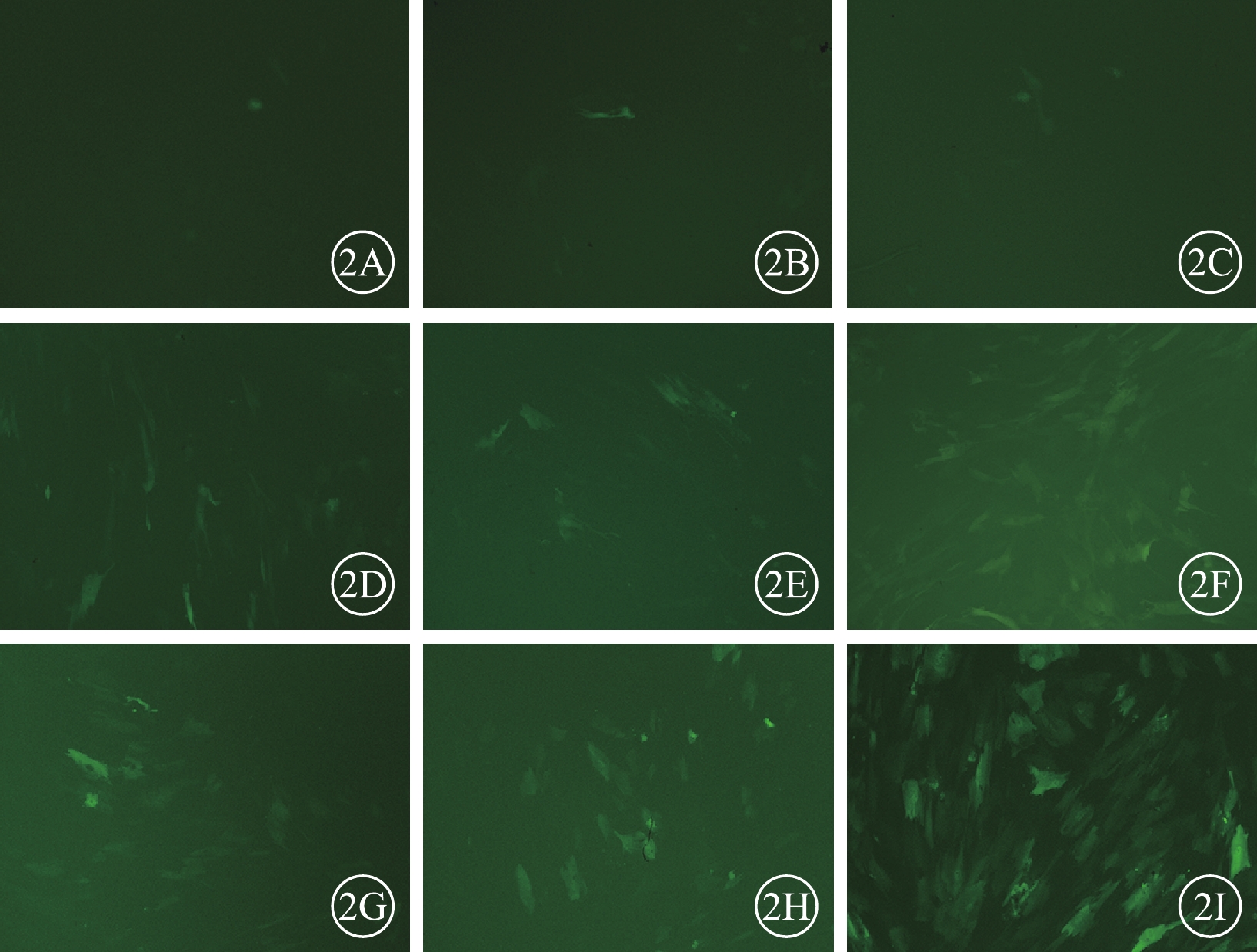
熒光顯微鏡觀察發現,轉染后48 h,10MOI實驗組、30MOI實驗組、50MOI實驗組細胞均僅有少許GFP表達(圖2A~2C);72 h,10MOI實驗組、30MOI實驗組、50MOI實驗組細胞GFP表達明顯增加(圖2D~2F);96 h,10MOI實驗組、30MOI實驗組細胞GFP表達較轉染后72 h增加(圖2G, 2H),50MOI實驗組細胞GFP表達明顯增強(圖2I)。
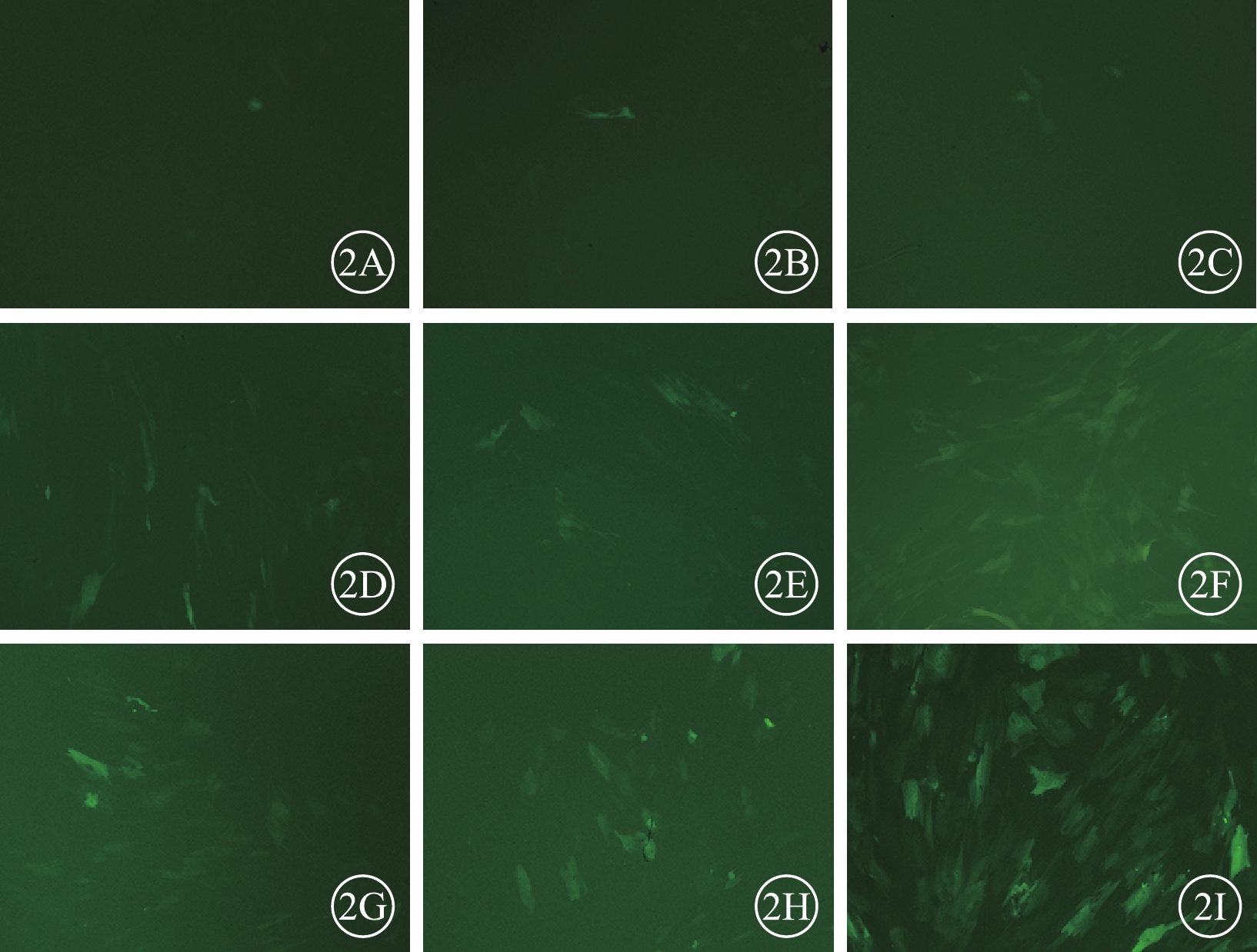 圖2
hUCMSCs熒光顯微鏡像。2A~2C、2D~2F、2G~2I分別為10MOI實驗組、30MOI實驗組、50MOI實驗組轉染后48、72、96 h。細胞均可見GFP表達 ×100
圖2
hUCMSCs熒光顯微鏡像。2A~2C、2D~2F、2G~2I分別為10MOI實驗組、30MOI實驗組、50MOI實驗組轉染后48、72、96 h。細胞均可見GFP表達 ×100
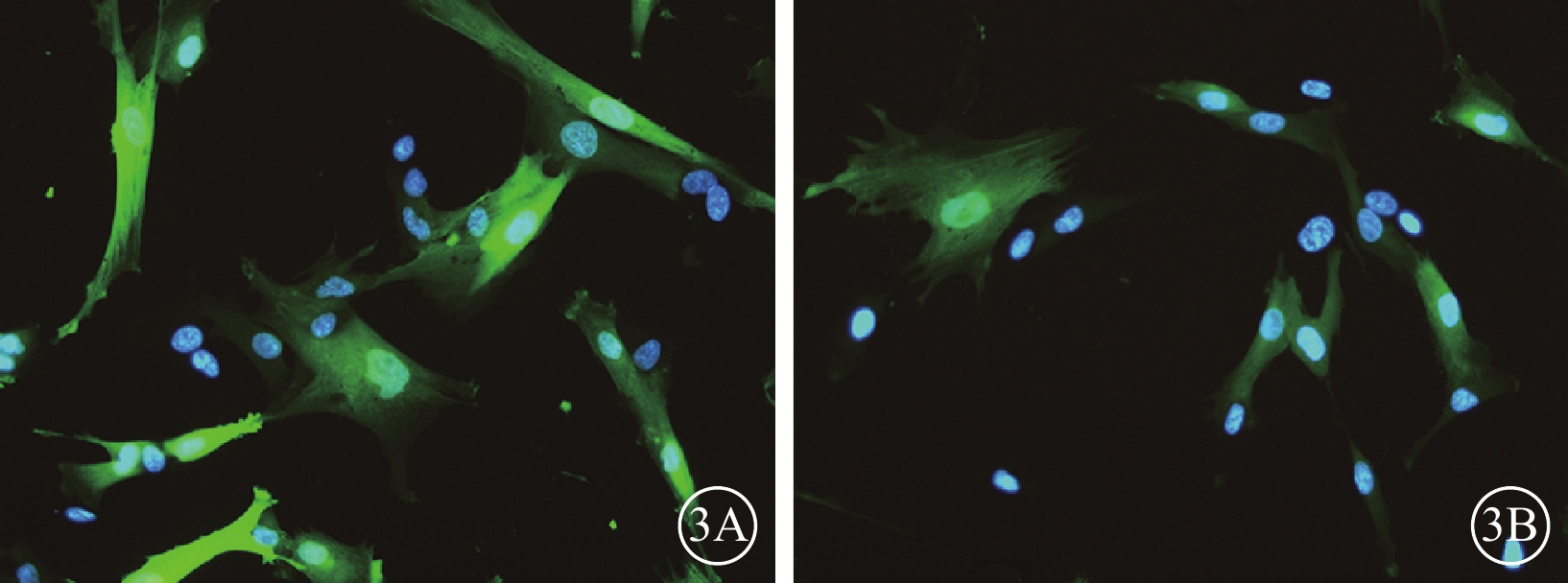
轉染后72 h,50MOI對照組細胞轉染效率為77.8%(圖3A);轉染后96 h,50MOI實驗組細胞轉染效率為72.1%(圖3B)。
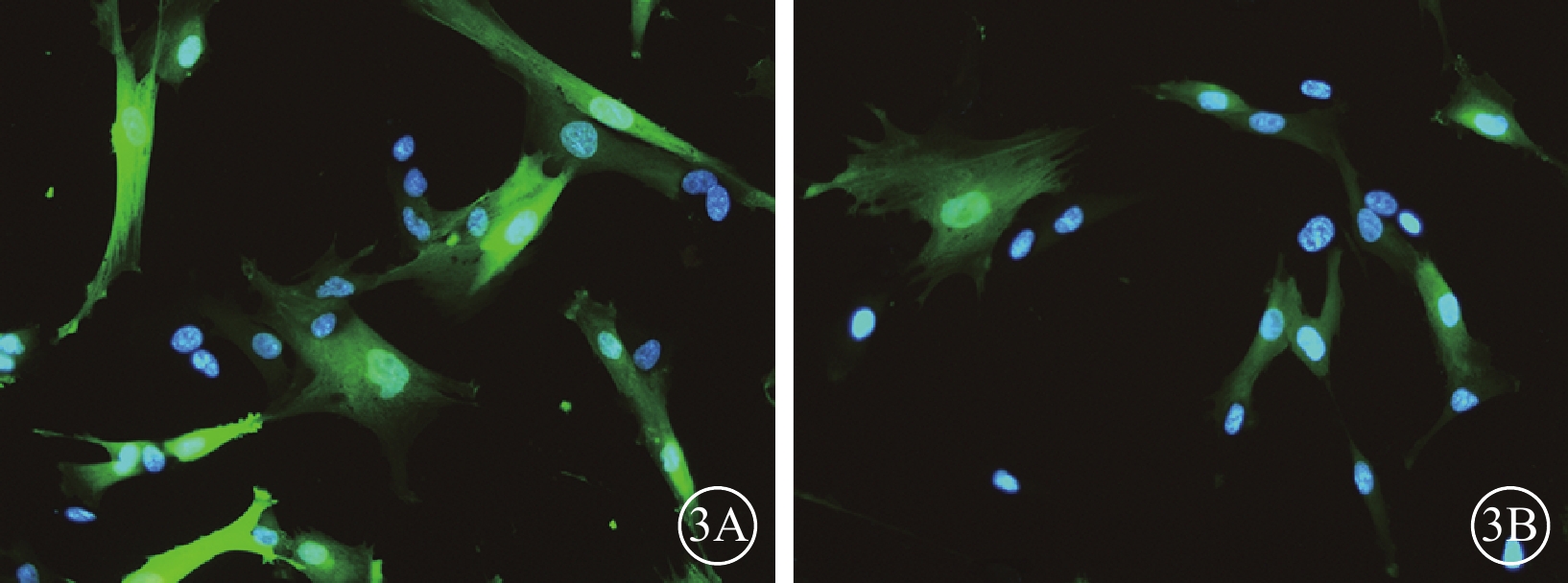 圖3
hUCMSCs熒光顯微鏡像。3A.50MOI對照組細胞轉染后72 h,可見GFP表達,轉染效率77.8%;3B.50MOI實驗組細胞轉染后96 h,可見GFP表達,轉染效率72.1%。藍色標記為DAPI,綠色標記為GFP ×200
圖3
hUCMSCs熒光顯微鏡像。3A.50MOI對照組細胞轉染后72 h,可見GFP表達,轉染效率77.8%;3B.50MOI實驗組細胞轉染后96 h,可見GFP表達,轉染效率72.1%。藍色標記為DAPI,綠色標記為GFP ×200
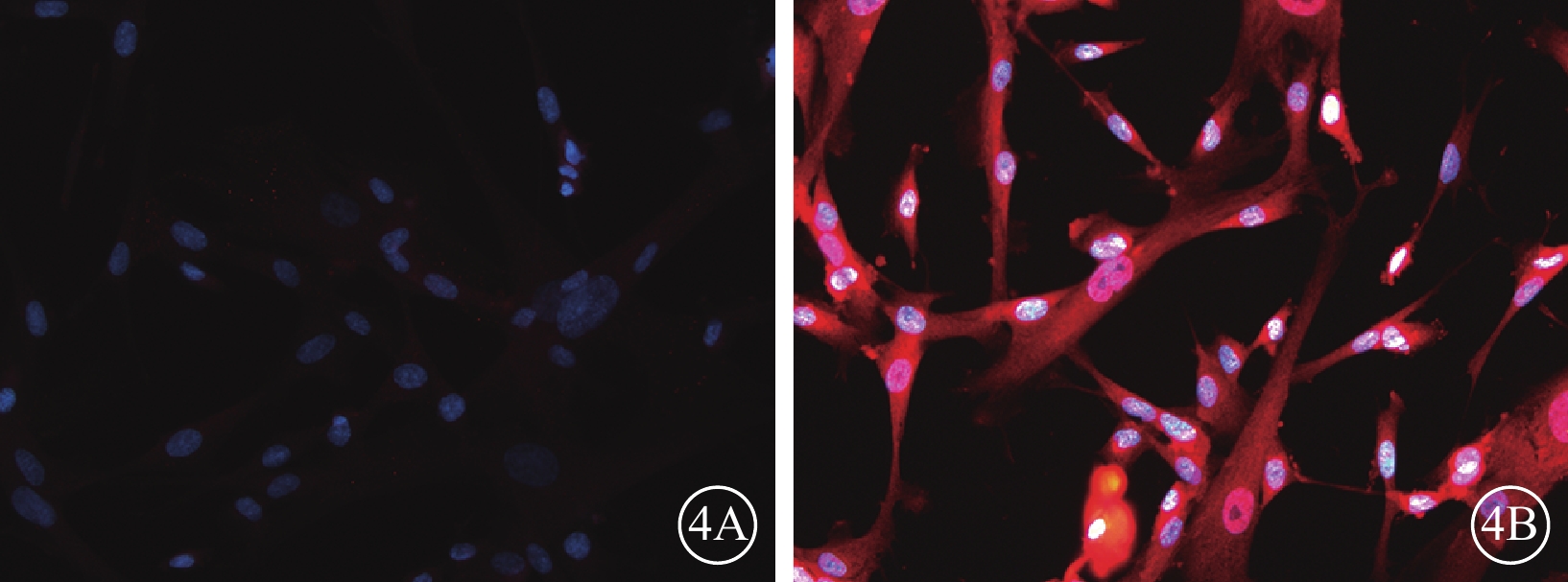
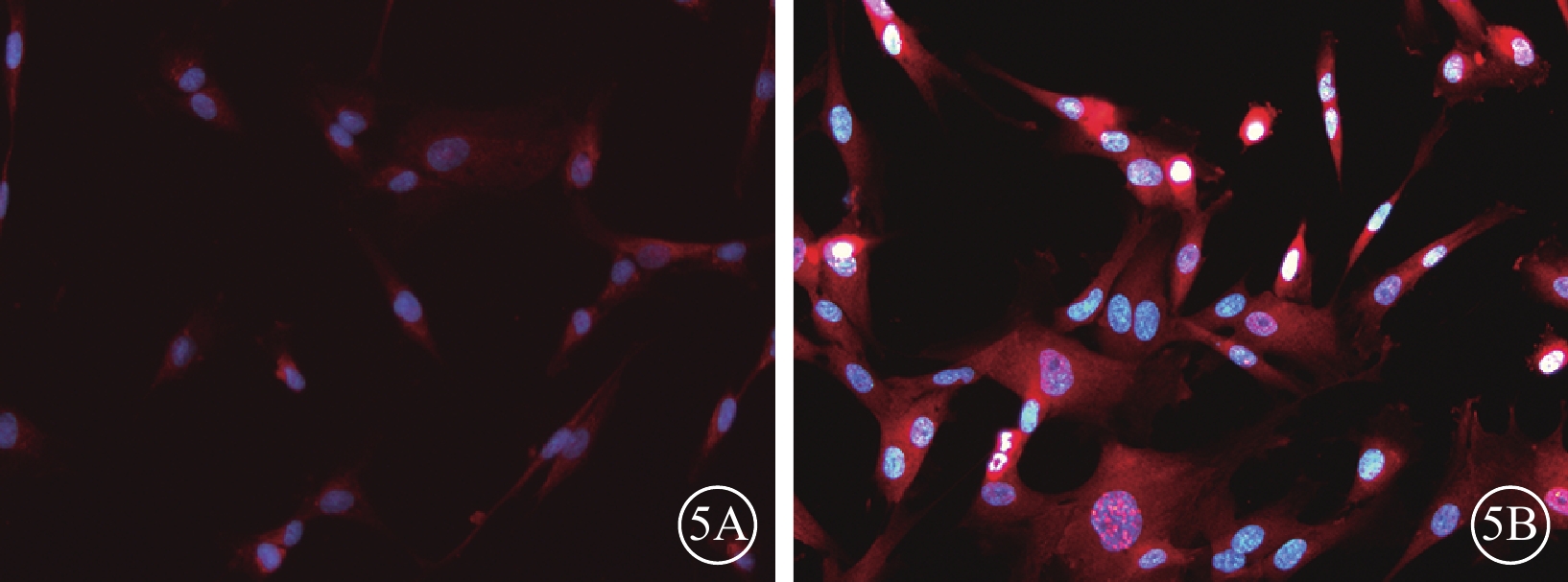
熒光顯微鏡觀察發現,轉染后72 h,50MOI對照組細胞胞漿PEDF表達微弱(圖4A),而VEGF表達較強(圖4B);轉染后96 h,50MOI實驗組細胞胞漿PEDF表達增強(圖5A),而VEGF表達仍較強(圖5B),但與50MOI對照組細胞相比其熒光強度較弱。
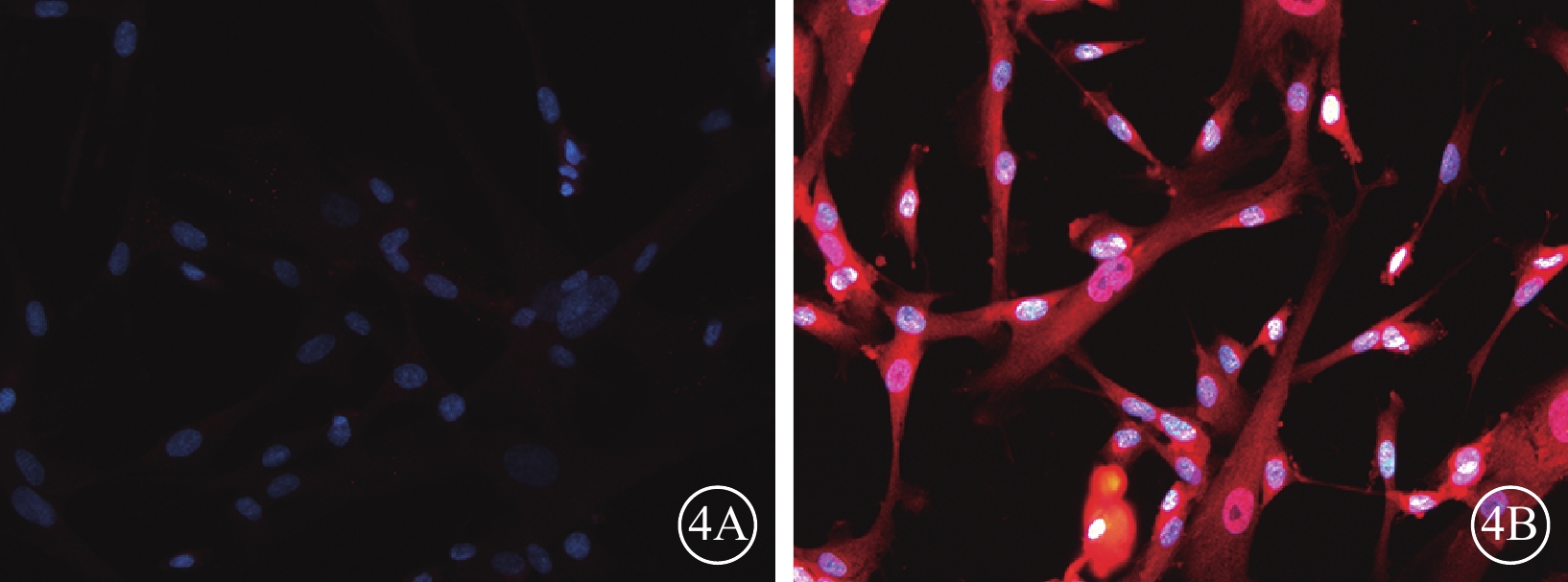 圖4
50MOI對照組細胞轉染后72 h熒光顯微鏡像。4A. PEDF;4B. VEGF。細胞胞漿PEDF表達微弱,VEGF表達較強。藍色標記為DAPI,紅色標記為TRIC ×200
圖4
50MOI對照組細胞轉染后72 h熒光顯微鏡像。4A. PEDF;4B. VEGF。細胞胞漿PEDF表達微弱,VEGF表達較強。藍色標記為DAPI,紅色標記為TRIC ×200
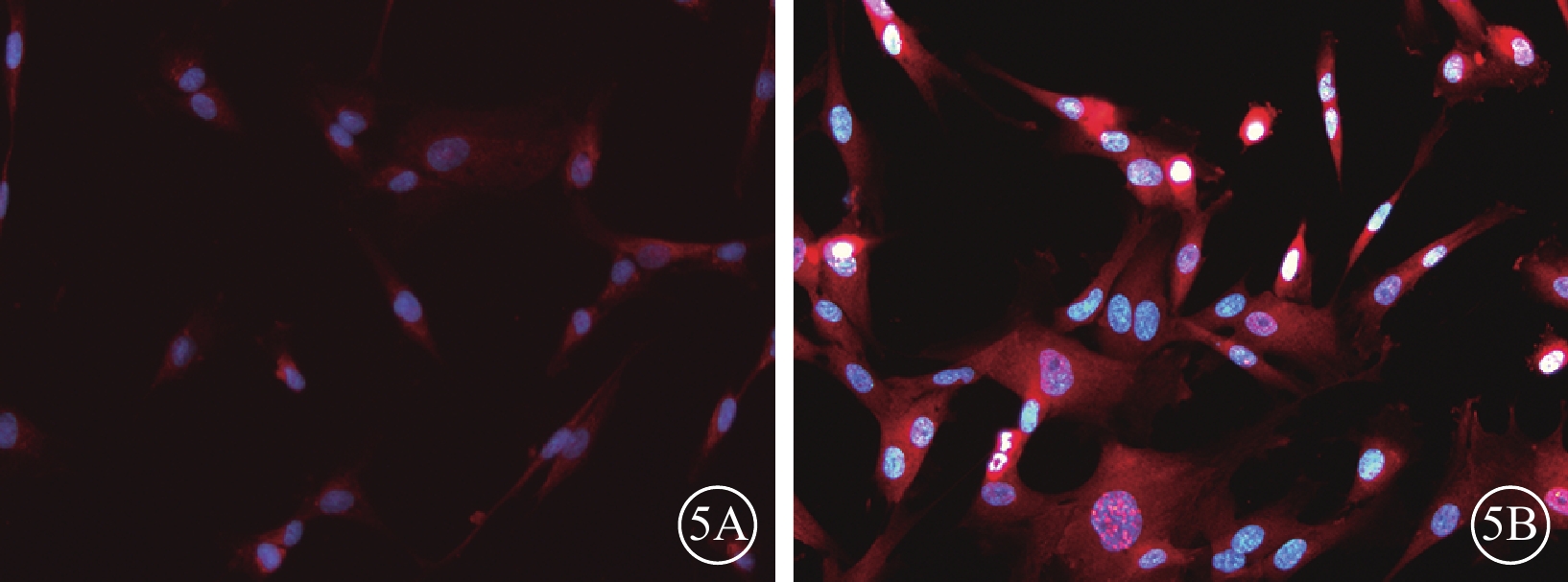 圖5
50MOI實驗組細胞轉染后96 h熒光顯微鏡像。5A. PEDF;5B. VEGF。細胞胞漿PEDF表達增強,VEGF表達仍較強。藍色標記為DAPI,紅色標記為TRIC ×200
圖5
50MOI實驗組細胞轉染后96 h熒光顯微鏡像。5A. PEDF;5B. VEGF。細胞胞漿PEDF表達增強,VEGF表達仍較強。藍色標記為DAPI,紅色標記為TRIC ×200
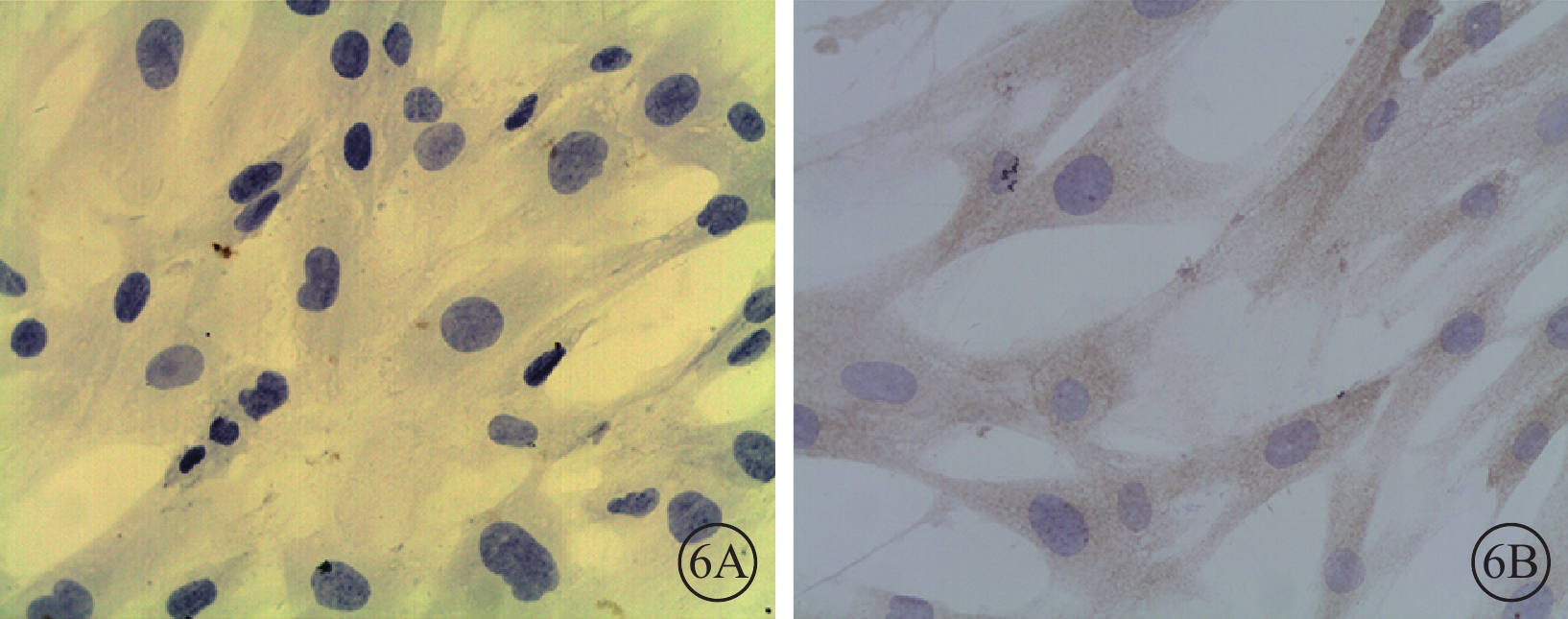
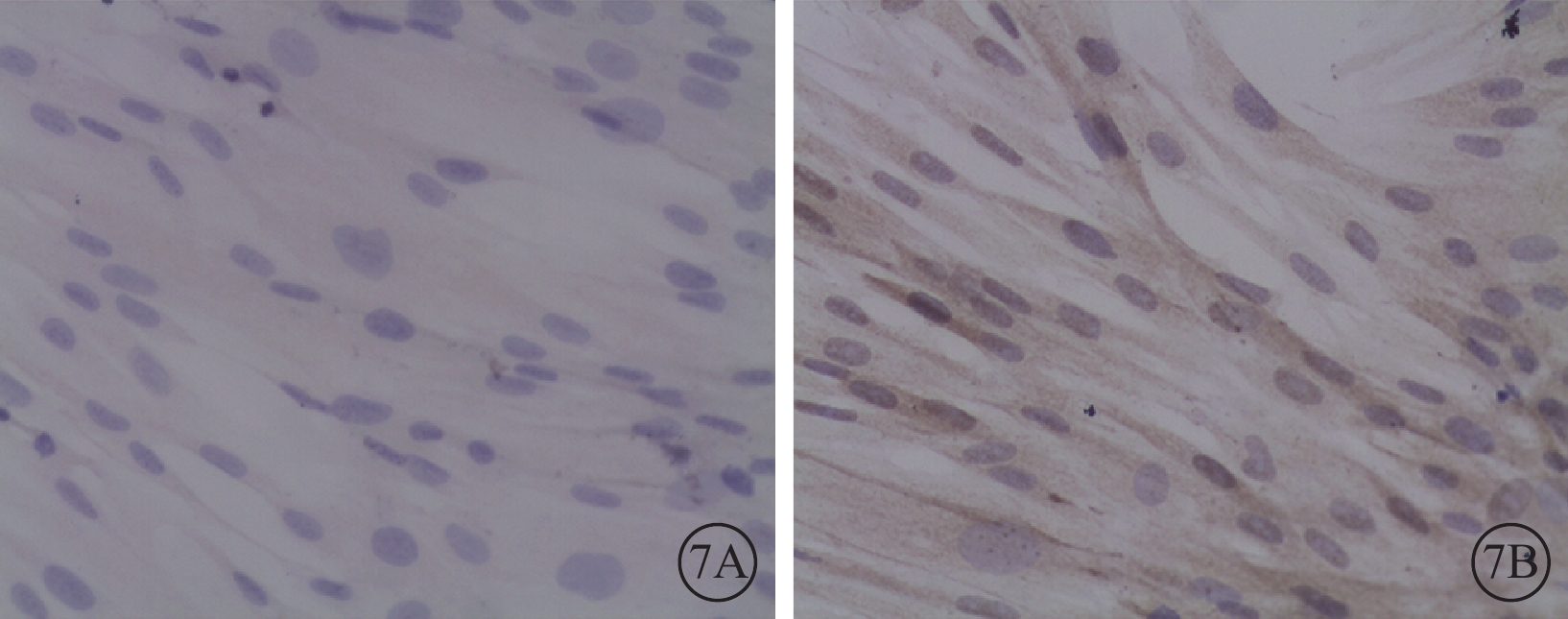
光學顯微鏡下觀察發現,轉染后96 h,50MOI對照組細胞胞漿未見PEDF表達(圖6A),而VEGF表達較強(圖6B);50MOI實驗組細胞胞漿PEDF表達較低(圖7A),而VEGF表達較強(圖7B),表達水平與50MOI對照組相似。
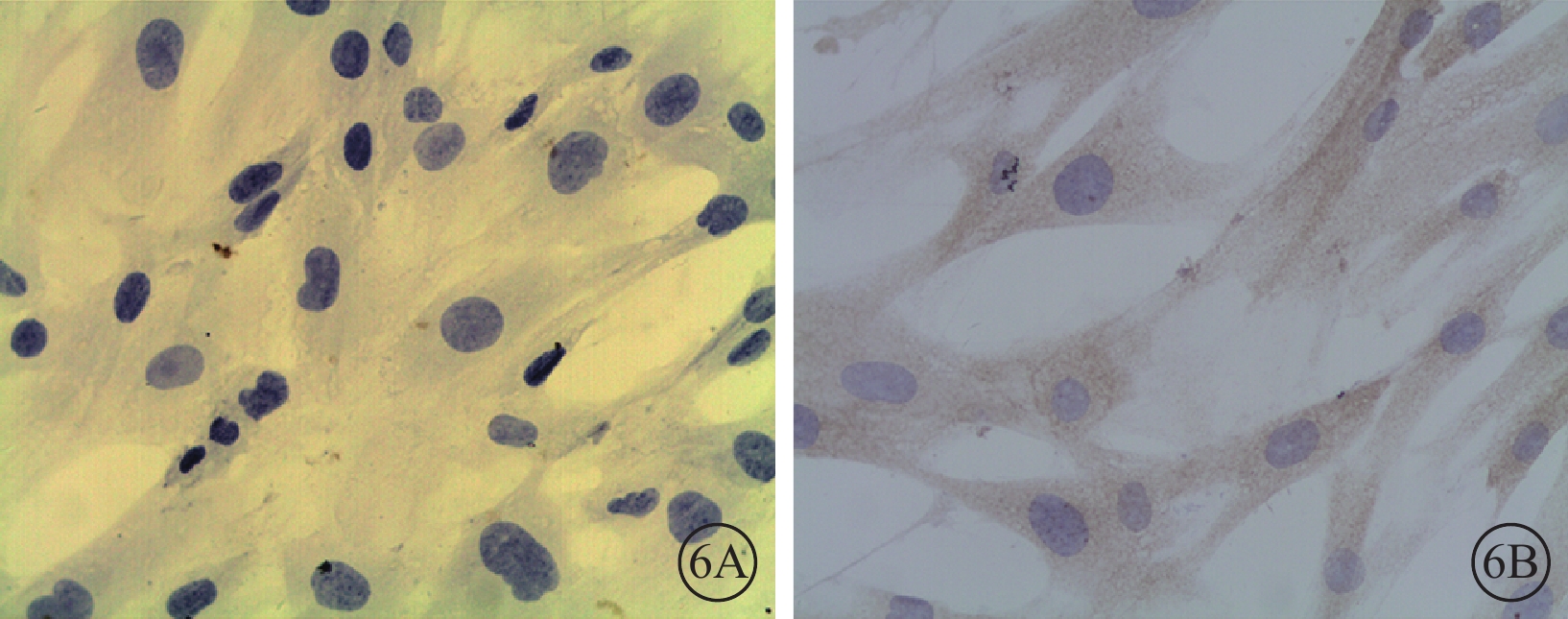 圖6
轉染96 h后50MOI對照組細胞光學顯微鏡像。6A. PEDF;6B. VEGF。細胞胞漿未見PEDF陽性細胞,而可見VEGF陽性細胞 DAB ×400
圖6
轉染96 h后50MOI對照組細胞光學顯微鏡像。6A. PEDF;6B. VEGF。細胞胞漿未見PEDF陽性細胞,而可見VEGF陽性細胞 DAB ×400
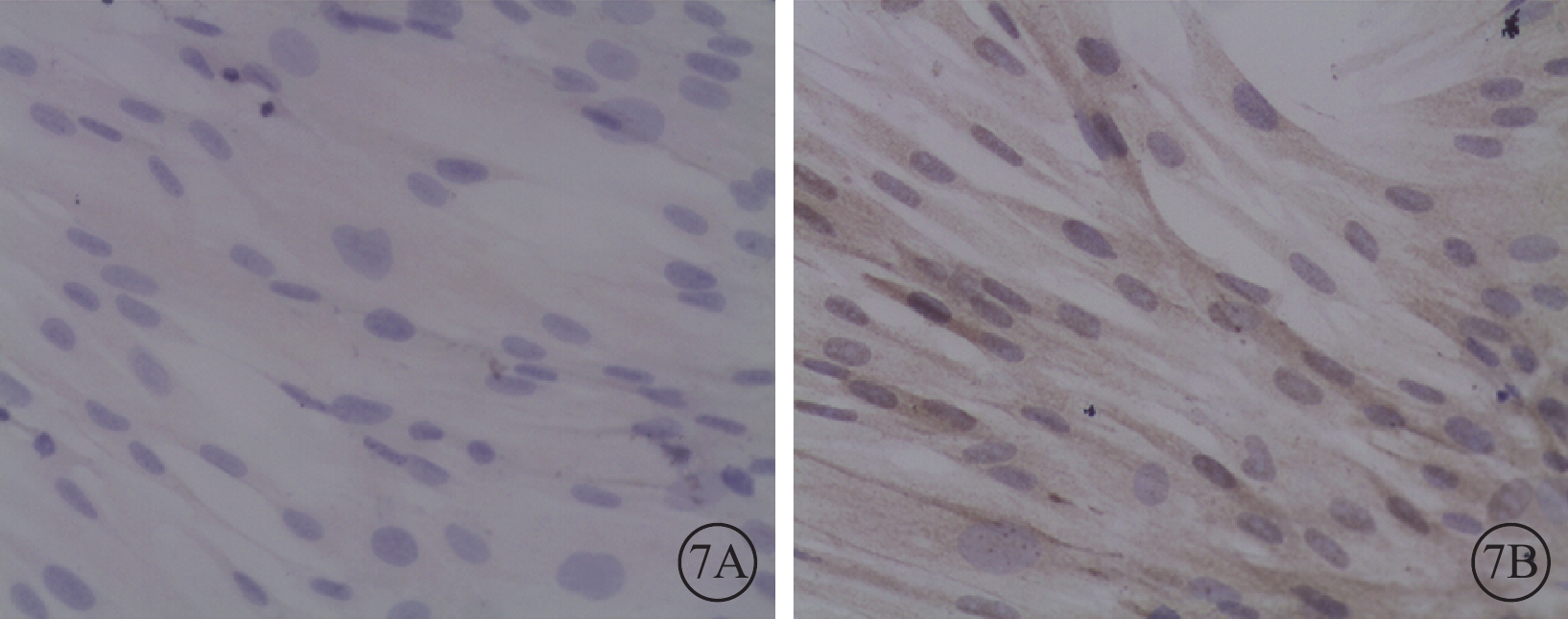 圖7
轉染96 h后50MOI實驗組細胞光學顯微鏡像。7A. PEDF;7B. VEGF。細胞胞漿呈棕黃色陽性表達 DAB ×400
圖7
轉染96 h后50MOI實驗組細胞光學顯微鏡像。7A. PEDF;7B. VEGF。細胞胞漿呈棕黃色陽性表達 DAB ×400
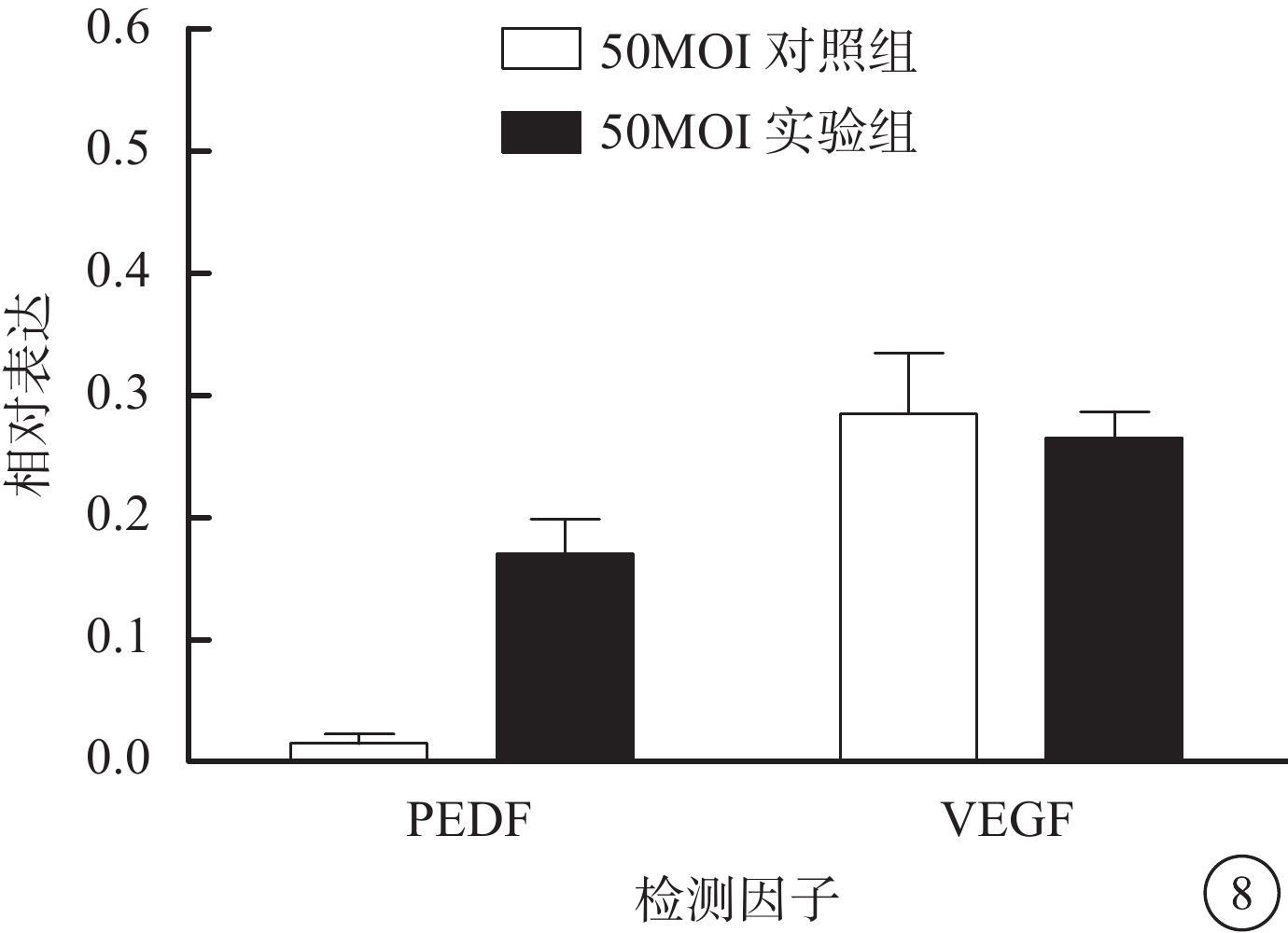
RT-PCR檢測結果發現,50MOI實驗組、50MOI對照組細胞中PEDF mRNA相對表達量分別為0.170±0.028、0.015±0.007;VEGF mRNA相對表達量分別為0.265±0.022、0.285±0.049。兩組細胞中PEDF mRNA相對表達量比較,差異有統計學意義(F=70.29,P<0.001);VEGF mRNA相對表達量比較,差異無統計學意義(F=9.57,P>0.05)(圖8)。
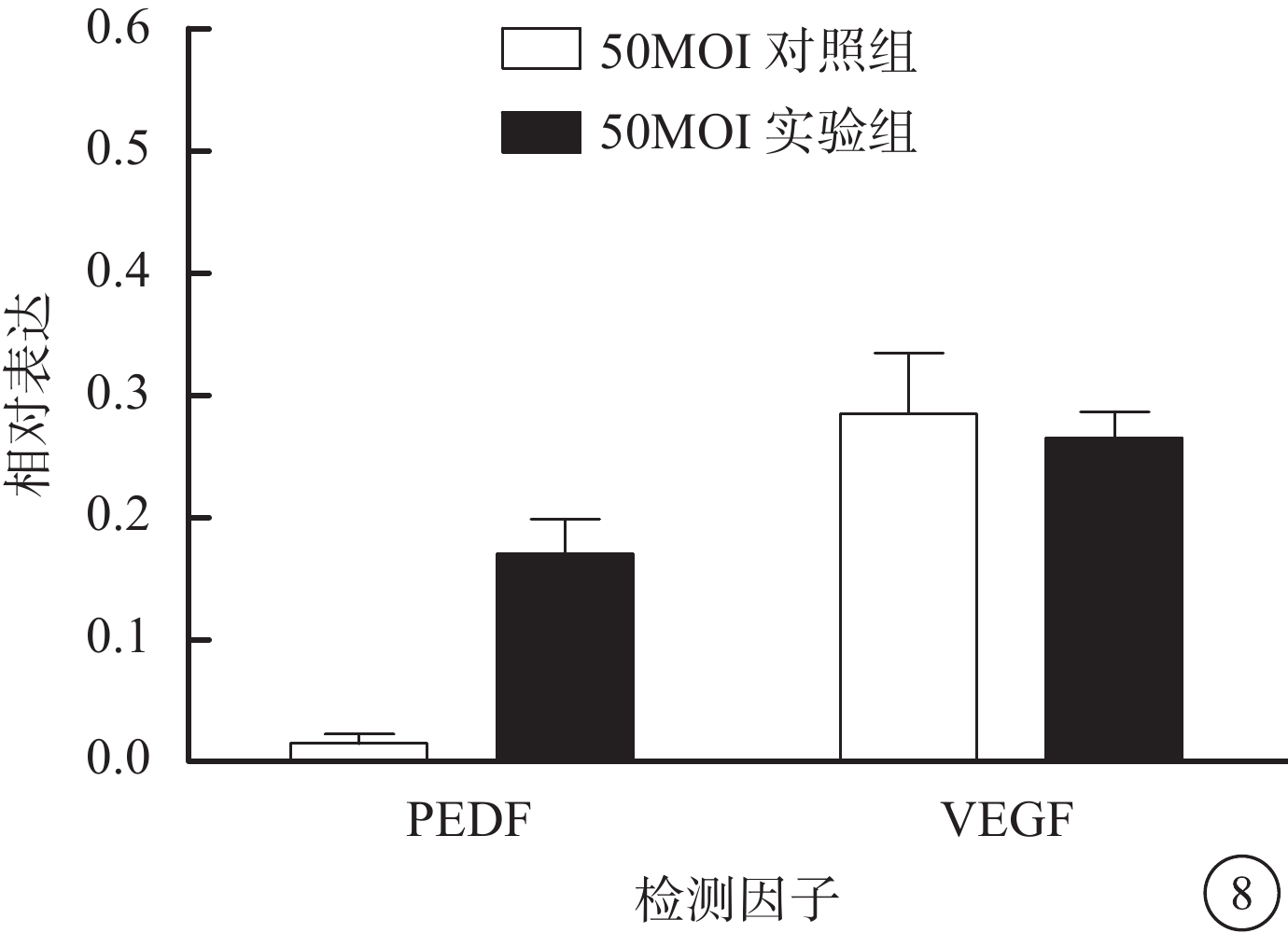 圖8
50MOI實驗組、50MOI對照組細胞中PEDF mRNA相對表達結果
圖8
50MOI實驗組、50MOI對照組細胞中PEDF mRNA相對表達結果
3 討論
MSCs目前已被廣泛應用于視網膜疾病的替代治療研究,可分化為神經細胞[5]、視網膜色素上皮(RPE)細胞[6]、光感受器細胞[7],可重建和代替受損的視網膜組織,也可通過分泌神經營養因子發揮作用[8, 9]。Park等[10]研究發現,視網膜下注射骨髓MSCs可整合入視網膜;而將骨髓MSCs注射入視網膜色素變性動物模型視網膜下,其可向RPE細胞、光感受器細胞及膠質系細胞分化[11]。PEDF與VEGF的失衡機制在糖尿病視網膜病變及其他新生血管相關的眼病中發揮重要作用[12]。研究表明,玻璃體與視網膜中PEDF濃度降低可能導致了增生型DR的發生[13, 14]。hUCMSCs是一種從臍帶獲取的成體干細胞,本研究結果顯示,hUCMSCs表達CD105、CD73和CD90,不表達CD34、CD45、CD11b、CD19和HLA-DR,與其他如骨髓、臍帶血等來源的MSCs表面標志一致[15, 16]。LV載體是以人類免疫缺陷型病毒為基礎的基因治療載體[17],具有良好的生物安全性[18]。在構建LV載體時,以GFP作為報告基因,便于顯微鏡下觀察。Ji等[19]研究表明,GFP基因可高效率在體外轉染hUCMSCs,且并不影響其多向分化潛能,細胞穩定性好,可進行連續傳代培養。
本研究采用PEDF基因重組LV載體轉染hUCMSCs,成功轉染后的hUCMSCs僅生長速度略低于對照組,但細胞形態、透明度均未受到影響;不同的MOI值影響轉染效率,本研究尚未發現對hUCMSCs產生明顯損傷的MOI值。其可能原因是所選用的MOI值不夠高,需要增加病毒數量進一步研究;通過LV-GFP對細胞的轉染情況來看,細胞生長狀態與未轉染細胞無明顯差異;此外,由于時間關系,本研究觀察時間較短,并未對細胞增生活力進行檢測,尚未能發現明顯的毒性反應,我們將在進一步研究中逐步探索。
Fan等[20]的研究觀察到骨髓MSCs中PEDF的表達強于VEGF,表明正常環境下MSCs不僅只有通常的促血管生成作用。這也支持了有關MSCs具有抑制血管生成的作用[21]。本研究采用細胞免疫化學染色未觀察到hUCMSCs中有明顯的PEDF陽性表達,但細胞免疫熒光染色法觀察到hUCMSCs中有中低表達。推測可能原因是由于PEDF在hUCMSCs中含量較骨髓MSCs低,確切原因需要進一步實驗加以證實。hUCMSCs作為基因治療的靶向載體,本研究結果為下一步體內實驗提供了理論依據。PEDF-MSCs可增加PEDF表達而并不增加VEGF的表達水平,PEDF-MSCs可能為眼部新生血管類疾病的治療拓展新思路。
間充質干細胞(MSCs)是一種具有自我更新、多向分化潛能的干細胞,因其免疫原性極低,性能穩定,易于獲得和擴增;不同來源MSCs已應用于多種視網膜相關疾病的研究[1]。色素上皮衍生因子(PEDF)是一種多功能因子,具有營養作用和多種生物活性,如抗血管生成、抗增生、促分化、抗炎和抗腫瘤等[2-4]。但因其半衰期短,應用受到限制。本研究將PEDF基因導入人臍帶MSCs(hUCMSCs)中,使得hUCMSCs高表達PEDF。初步探討基因修飾的hUCMSCs(PEDF-MSCs)的可行性與安全性,為PEDF-MSCs在眼部新生血管類疾病研究提供實驗基礎。現將結果報道如下。
1 材料和方法
1.1 材料
原代hUCMSCs由中國醫學科學院血液學研究所泰達生命科學技術研究中心惠贈。抗原分化簇(CD)(美國BD公司);聚凝胺(polybrene)(美國Santa Cruze公司);總RNA提取試劑盒(中國北京賽百盛基因技術有限公司);dNTP(美國Invitrogen公司);聚合酶鏈反應(PCR)引物(中國北京奧科生物技術有限公司);SYBR Premix Ex Taq Ⅰ(日本Takara公司);RNA酶抑制劑(日本Takara公司);DNA marker、DNA marker DL2000(日本Takara公司);Taq DNA聚合酶(日本Takara公司);寡聚胸苷酸引物(日本Takara公司);莫洛尼鼠白血病病毒cDNA合成試劑盒(美國Invitrogen公司);熒光倒置顯微鏡(日本Olympus公司);熒光定量PCR儀(德國Eppendorf公司);酶標儀(美國Thermo公司)。
1.2 hUCMSCs培養與免疫表型檢測
原代hUCMSCs置于T75 cm2培養瓶傳代培養,加入含10% 胎牛血清(FBS)、100 μg/ml青霉素、100 μg/ml鏈霉素的DF12完全培養基15 ml。置于37℃,飽和濕度,含5% CO2細胞培養箱中培養,貼壁生長至80%~90%融合時,根據需求按照1:2或1:3進行傳代,純化細胞,取4~6代細胞用于實驗。倒置顯微鏡下觀察細胞形態變化。
取第5代細胞,經0.25%胰蛋白酶或0.01%乙二胺四乙酸消化液消化分散為單個細胞,磷酸鹽緩沖鹽溶液(PBS)反復吹打沖洗,4500 r/min離心3 min,棄上清液。流式管中分別加入鼠抗人異硫氰酸熒光素(FITC)標記的CD19、CD34和鼠抗人藻紅蛋白(PE)標記的CD73、CD105、CD11b、CD45、CD90、HLA-DR (HLA-Ⅱ),同型對照管加入抗小鼠抗體IgG1-PE和IgG1-FITC;4 ℃避光孵育30 min,PBS沖洗后1%多聚甲醛(PFA)固定。流式細胞儀檢測分析細胞免疫表型。
1.3 構建PEDF重組慢病毒(LV)載體
從Genebank查取構建的基因信息: Homo sapiens PEDF, NCBI reference sequence: NM_002615;OEF sequence: 1257 堿基對(bp)。上游引物5′-ACCTCTAGAATGCAGGCCCTGGTGCTACTCC-3′,下游引物5′-CACGCGGCCGCTTAGGGGCCCCTGGGGTCCAGA-3′,并在兩端分別引入XbaⅠ和NotⅠ酶切位點(下劃線標出)及保護堿基,PCR擴增PEDF基因片段開放閱讀框全長;擴增產物經瓊脂糖凝膠電泳分離,DNA凝膠回收試劑盒回收,克隆入pGEM-T easy載體;再轉化大腸桿菌感受態細胞,接種在氨芐霉素抗性平板上,16 h后挑取經藍白斑篩選的陽性克隆,置于Luria-Bertani液體培養基,37 ℃振蕩培養18 h,菌落PCR鑒定的陽性克隆用Qiagen質粒小提試劑盒提取質粒,并測序驗證;驗證正確的克隆用XbaⅠ和NotⅠ雙酶切后與經同樣雙酶切的攜帶綠色熒光蛋白(GFP)基因的LV載體pCDH-CMV-MCS-EF1-copGFP相連接,構建PEDF-GFP共表達載體。以pCDH-CMV-MCS-EF1-copGFP載體作為對照。病毒滴度的測定通過將病毒稀釋成不同濃度浸染293T細胞,通過檢測不同稀釋倍數的病毒感染293細胞的效率計算病毒滴度,轉染前將病毒滴度調整為5×108 TU/ml備用。
1.4 PEDF重組LV載體轉染hUCMSCs及轉染效率
將培養的hUCMSCs接種到6孔板,待其融合度約為50%~70%時,吸取原有培養基,加入新鮮的Dulbecco改良Eagle培養基/F12培養基,每孔2 ml。每孔加入1 μl polybrene, 放入培養箱孵育30 min。細胞長至約50%融合時,以感染復數(MOI)值為10、30、50的PEDF基因重組LV載體(LV-PEDF-GFP)分別轉染3孔細胞(10MOI實驗組、30MOI實驗組、50MOI實驗組),其余3孔細胞為相應MOI對照組,用不含PEDF基因的相同MOI值的重組LV載體(LV-GFP)進行轉染。混勻后,37 ℃培養箱孵育12 h。12 h后吸取含病毒的培養基,更換為新鮮培養基,37℃培養箱繼續培養。各組細胞轉染后48、72、96 h熒光顯微鏡觀察細胞GFP表達。
將無菌細胞爬片置于6孔板,加入細胞懸液,37 ℃,24 h,PBS沖洗2次,4% PFA固定20 min,PBS沖洗2次,加入0.2% 聚乙二醇辛基苯基醚(triton-100),室溫避光,10 min,PBS沖洗2次,滴加二脒基苯基吲哚(DAPI),染色5 min。PBS沖洗2次,50%甘油固定。熒光顯微鏡下轉染成功的細胞胞漿呈綠色,以此計數轉染效率;分別選取5個視野,計算平均值。
1.5 免疫熒光檢測細胞PEDF、VEGF表達
選取LV-PEDF-GFP、LV-GFP轉染后72、96 h 50MOI實驗組、50MOI對照組細胞,平鋪于含有細胞爬片的24孔板中,細胞濃度5×104/ml,冰PBS終止刺激,4% PFA固定10 min,PBS沖洗3次,加入0.2% triton-100室溫避光10 min;PBS沖洗3次,加入1 ml 3% 牛血清白蛋白室溫封閉1 h;PBS沖洗1次,加入一抗PEDF(1:100)、VEGF(1:100),4 ℃過夜;PBS沖洗3次,加入二抗(1:100),避光,室溫孵育1 h;PBS沖洗3次,加入DAPI染核(1:1 000),避光室溫10 min;PBS沖洗2次,將爬片移至載玻片上,50%甘油封閉。實驗重復3次。熒光顯微鏡觀察。紅色為TRIC標記的陽性細胞,藍色為DAPI細胞核染色。
1.6 免疫細胞化學法檢測hUCMSCs中PEDF、VEGF表達
選取轉染后96 h的50MOI對照組、50MOI實驗組細胞爬片,方法同免疫熒光檢測。鏈霉菌抗生物素蛋白-過氧化物酶連結(SP)法行免疫細胞化學染色,二氨基聯苯胺(DAB)顯色,陽性細胞表達棕色;細胞核蘇木精復染。光學顯微鏡下觀察。
1.7 實時定量PCR(RT-PCR)檢測MOI50實驗組、MOI50對照組細胞中PEDF、VEGF mRNA表達
采用primer premier 5.0和Oligo 6.0 軟件設計特異性引物。PEDF,上游引物:5′-TTCACCCGGAGCAGTGAT-3′, 下游引物: 5′-GCCTCCAGAATTGTGTTTGAG-3′;VEGF,上游引物: 5′-CTATGCAGATCATGCGGATCA-3′, 下游引物: 5′-TATGCTGCAGGAAGCTCATCTC-3′。擴增條件預變性95 ℃ 15 s,變性95 ℃ 15 s,退火57 ℃ 30 s,延伸74 ℃ 30 s,保存4 ℃,45個循環。反應結束后,根據測得的樣品Ct值,以2?△△Ct表示目的基因mRNA相對表達值。以β-肌動蛋白(actin)為內參照,每份模板的每個基因重復3次檢測。應用2?△△CT法進行數據處理,計算各標本目的基因相對于對照組某一標本的相對表達量。
1.8 統計學方法
采用SPSS 19.0統計學軟件行統計分析。各組數據以均數±標準差(
 )表示。正態概率圖顯示各組數據呈近似正態分布,方差齊性檢驗顯示方差齊,組間比較行獨立樣本t檢驗。P<0.05為差異有統計學意義。
)表示。正態概率圖顯示各組數據呈近似正態分布,方差齊性檢驗顯示方差齊,組間比較行獨立樣本t檢驗。P<0.05為差異有統計學意義。
2 結果
倒置顯微鏡觀察發現,hUCMSCs培養4~5 h后部分開始貼壁生長,呈短梭形,散在分布;未貼壁細胞為圓形。5~7 d后可見細胞呈長梭形,80%~90%融合,形態相對均一,呈漩渦狀排列(圖1)。流式細胞儀測定結果顯示,CD105(SH2)、CD73(SH3)、CD90陽性率95%以上;CD34、CD45、CD11b、CD19和HLA-DR(HLA-Ⅱ)陽性率低于2%。
 圖1
hUCMSCs光學顯微鏡像。培養的hUCMSCs呈長梭形生長,漩渦狀排列。×40
圖1
hUCMSCs光學顯微鏡像。培養的hUCMSCs呈長梭形生長,漩渦狀排列。×40
熒光顯微鏡觀察發現,轉染后48 h,10MOI實驗組、30MOI實驗組、50MOI實驗組細胞均僅有少許GFP表達(圖2A~2C);72 h,10MOI實驗組、30MOI實驗組、50MOI實驗組細胞GFP表達明顯增加(圖2D~2F);96 h,10MOI實驗組、30MOI實驗組細胞GFP表達較轉染后72 h增加(圖2G, 2H),50MOI實驗組細胞GFP表達明顯增強(圖2I)。
 圖2
hUCMSCs熒光顯微鏡像。2A~2C、2D~2F、2G~2I分別為10MOI實驗組、30MOI實驗組、50MOI實驗組轉染后48、72、96 h。細胞均可見GFP表達 ×100
圖2
hUCMSCs熒光顯微鏡像。2A~2C、2D~2F、2G~2I分別為10MOI實驗組、30MOI實驗組、50MOI實驗組轉染后48、72、96 h。細胞均可見GFP表達 ×100
轉染后72 h,50MOI對照組細胞轉染效率為77.8%(圖3A);轉染后96 h,50MOI實驗組細胞轉染效率為72.1%(圖3B)。
 圖3
hUCMSCs熒光顯微鏡像。3A.50MOI對照組細胞轉染后72 h,可見GFP表達,轉染效率77.8%;3B.50MOI實驗組細胞轉染后96 h,可見GFP表達,轉染效率72.1%。藍色標記為DAPI,綠色標記為GFP ×200
圖3
hUCMSCs熒光顯微鏡像。3A.50MOI對照組細胞轉染后72 h,可見GFP表達,轉染效率77.8%;3B.50MOI實驗組細胞轉染后96 h,可見GFP表達,轉染效率72.1%。藍色標記為DAPI,綠色標記為GFP ×200
熒光顯微鏡觀察發現,轉染后72 h,50MOI對照組細胞胞漿PEDF表達微弱(圖4A),而VEGF表達較強(圖4B);轉染后96 h,50MOI實驗組細胞胞漿PEDF表達增強(圖5A),而VEGF表達仍較強(圖5B),但與50MOI對照組細胞相比其熒光強度較弱。
 圖4
50MOI對照組細胞轉染后72 h熒光顯微鏡像。4A. PEDF;4B. VEGF。細胞胞漿PEDF表達微弱,VEGF表達較強。藍色標記為DAPI,紅色標記為TRIC ×200
圖4
50MOI對照組細胞轉染后72 h熒光顯微鏡像。4A. PEDF;4B. VEGF。細胞胞漿PEDF表達微弱,VEGF表達較強。藍色標記為DAPI,紅色標記為TRIC ×200
 圖5
50MOI實驗組細胞轉染后96 h熒光顯微鏡像。5A. PEDF;5B. VEGF。細胞胞漿PEDF表達增強,VEGF表達仍較強。藍色標記為DAPI,紅色標記為TRIC ×200
圖5
50MOI實驗組細胞轉染后96 h熒光顯微鏡像。5A. PEDF;5B. VEGF。細胞胞漿PEDF表達增強,VEGF表達仍較強。藍色標記為DAPI,紅色標記為TRIC ×200
光學顯微鏡下觀察發現,轉染后96 h,50MOI對照組細胞胞漿未見PEDF表達(圖6A),而VEGF表達較強(圖6B);50MOI實驗組細胞胞漿PEDF表達較低(圖7A),而VEGF表達較強(圖7B),表達水平與50MOI對照組相似。
 圖6
轉染96 h后50MOI對照組細胞光學顯微鏡像。6A. PEDF;6B. VEGF。細胞胞漿未見PEDF陽性細胞,而可見VEGF陽性細胞 DAB ×400
圖6
轉染96 h后50MOI對照組細胞光學顯微鏡像。6A. PEDF;6B. VEGF。細胞胞漿未見PEDF陽性細胞,而可見VEGF陽性細胞 DAB ×400
 圖7
轉染96 h后50MOI實驗組細胞光學顯微鏡像。7A. PEDF;7B. VEGF。細胞胞漿呈棕黃色陽性表達 DAB ×400
圖7
轉染96 h后50MOI實驗組細胞光學顯微鏡像。7A. PEDF;7B. VEGF。細胞胞漿呈棕黃色陽性表達 DAB ×400
RT-PCR檢測結果發現,50MOI實驗組、50MOI對照組細胞中PEDF mRNA相對表達量分別為0.170±0.028、0.015±0.007;VEGF mRNA相對表達量分別為0.265±0.022、0.285±0.049。兩組細胞中PEDF mRNA相對表達量比較,差異有統計學意義(F=70.29,P<0.001);VEGF mRNA相對表達量比較,差異無統計學意義(F=9.57,P>0.05)(圖8)。
 圖8
50MOI實驗組、50MOI對照組細胞中PEDF mRNA相對表達結果
圖8
50MOI實驗組、50MOI對照組細胞中PEDF mRNA相對表達結果
3 討論
MSCs目前已被廣泛應用于視網膜疾病的替代治療研究,可分化為神經細胞[5]、視網膜色素上皮(RPE)細胞[6]、光感受器細胞[7],可重建和代替受損的視網膜組織,也可通過分泌神經營養因子發揮作用[8, 9]。Park等[10]研究發現,視網膜下注射骨髓MSCs可整合入視網膜;而將骨髓MSCs注射入視網膜色素變性動物模型視網膜下,其可向RPE細胞、光感受器細胞及膠質系細胞分化[11]。PEDF與VEGF的失衡機制在糖尿病視網膜病變及其他新生血管相關的眼病中發揮重要作用[12]。研究表明,玻璃體與視網膜中PEDF濃度降低可能導致了增生型DR的發生[13, 14]。hUCMSCs是一種從臍帶獲取的成體干細胞,本研究結果顯示,hUCMSCs表達CD105、CD73和CD90,不表達CD34、CD45、CD11b、CD19和HLA-DR,與其他如骨髓、臍帶血等來源的MSCs表面標志一致[15, 16]。LV載體是以人類免疫缺陷型病毒為基礎的基因治療載體[17],具有良好的生物安全性[18]。在構建LV載體時,以GFP作為報告基因,便于顯微鏡下觀察。Ji等[19]研究表明,GFP基因可高效率在體外轉染hUCMSCs,且并不影響其多向分化潛能,細胞穩定性好,可進行連續傳代培養。
本研究采用PEDF基因重組LV載體轉染hUCMSCs,成功轉染后的hUCMSCs僅生長速度略低于對照組,但細胞形態、透明度均未受到影響;不同的MOI值影響轉染效率,本研究尚未發現對hUCMSCs產生明顯損傷的MOI值。其可能原因是所選用的MOI值不夠高,需要增加病毒數量進一步研究;通過LV-GFP對細胞的轉染情況來看,細胞生長狀態與未轉染細胞無明顯差異;此外,由于時間關系,本研究觀察時間較短,并未對細胞增生活力進行檢測,尚未能發現明顯的毒性反應,我們將在進一步研究中逐步探索。
Fan等[20]的研究觀察到骨髓MSCs中PEDF的表達強于VEGF,表明正常環境下MSCs不僅只有通常的促血管生成作用。這也支持了有關MSCs具有抑制血管生成的作用[21]。本研究采用細胞免疫化學染色未觀察到hUCMSCs中有明顯的PEDF陽性表達,但細胞免疫熒光染色法觀察到hUCMSCs中有中低表達。推測可能原因是由于PEDF在hUCMSCs中含量較骨髓MSCs低,確切原因需要進一步實驗加以證實。hUCMSCs作為基因治療的靶向載體,本研究結果為下一步體內實驗提供了理論依據。PEDF-MSCs可增加PEDF表達而并不增加VEGF的表達水平,PEDF-MSCs可能為眼部新生血管類疾病的治療拓展新思路。