引用本文: 武斌, 陳松, 張惟, 何廣輝, 王健. 阿托伐他汀對體外培養的大鼠骨髓間充質干細胞CXC趨化因子受體4表達及遷移能力的影響. 中華眼底病雜志, 2018, 34(6): 575-579. doi: 10.3760/cma.j.issn.1005-1015.2018.06.010 復制
糖尿病視網膜病變(DR)是工作年齡人群致盲的首要原因[1]。間充質干細胞(MSC)具有多向分化潛能、低免疫原性和免疫赦免等特性[2-3],被廣泛應用于多種疾病的預防和治療。近年來,MSC移植治療DR表現出良好的應用前景[4],但其存在體內存活率低、分化效率低、歸巢能力差的缺點[5-7]。據報道,基質細胞衍生因子-1(SDF-1)/CXC趨化因子受體4(CXCR4)信號通路在MSC的歸巢、趨化,黏附分子的表達和植入中發揮重要作用[8]。研究表明,阿托伐他汀(ATV)可以使腺苷磷酸(AMP)蛋白激酶磷酸化水平顯著升高,誘導內皮型一氧化氮合酶(eNOS)上調,一氧化氮的合成增加,這可能導致CXCR4的表達增加,促進歸巢[9-10]。本研究應用ATV處理的大鼠骨髓MSC(BMSC),初步探討通過藥物處理BMSC以增強其遷移歸巢能力的可行性,為研究BMSC對DR治療作用提供實驗基礎。現將結果報道如下。
1 材料和方法
?
抗原分化簇(CD)(美國BD公司);Polybrene(美國Santa Cruze公司);總RNA提取試劑盒(北京賽百盛基因技術有限公司);CXCR4單克隆抗體(美國Invitrogen公司);dNTP(美國Invitrogen公司);聚合酶鏈(PCR)引物(北京奧科生物技術有限公司);SYBR Premix Ex Taq Ⅰ、RNA酶抑制劑、脫氧核糖核酸Marker DL2000、TaqDNA聚合酶、Oligo Dt primer、DNA marker(日本Takara公司);M-MLV cDNA合成試劑盒(美國Invitrogen公司);熒光倒置顯微鏡(日本Olympus公司);熒光定量PCR儀(德國Eppendorf公司);酶標儀(美國Thermo公司)。
?
雌性Sprague Dawley大鼠12只,4~6周齡,體重80~100 g,無特定病原體級。天津醫科大學實驗動物科學部提供;實驗動物的使用符合國家科學技術委員會頒布的《實驗動物管理條例》。大鼠處死后無菌條件下取出雙側股骨、脛骨。Dubecoo改良Eagle(DMEM)培養基/F12培養液沖洗骨髓腔,將沖洗出的骨髓腔內容物室溫下離心,離心半徑10 cm,800 r/min離心5 min,棄上清。加入含10%胎牛血清的DMEM/F12培養液重懸細胞,接種至75 CIll2培養瓶中,37℃、5% CO2、飽和濕度下常規培養。48 h后首次換液.之后每72 h換液1次。細胞融合至80%以上后,按1∶2~1∶3傳代。倒置相差顯微鏡觀察細胞形態變化。細胞免疫熒光法檢測第4~6代BMSC表面分子CD11、CD44,鑒定BMSC。流式細胞儀檢測4~6代BMSC表面分子CD44、CD19、CD34等,鑒定BMSC。細胞培養至第4~6代時,重懸細胞使其濃度為1×105個/ml,37℃、5% CO2培養12 h后貼壁,在培養液中分別加入終濃度為0.0、0.1、1.0、10.0、100.0、1 000.0 nmol/L的ATV,處理BMSC 12 h;并據此分組,0.0 nmol/L組為對照組,余為不同濃度實驗組。
細胞免疫熒光法檢測不同濃度組細胞中CXCR4蛋白表達情況。收集培養貼壁的BMSC,調整細胞濃度為2×105個/L,加入4%多聚甲醛固定20 min;除去多聚甲醛,0.3%Triton X-100室溫通透20 min;除去Triton X-100,5%牛血清白蛋白封閉1 h;滴加足夠量適宜濃度的一抗CXCR4,4℃孵育過夜;除去一抗,滴加足夠量適宜濃度的二抗,37℃,30 min;除去二抗;滴加一滴含4',6-二脒基-2-苯基吲哚(DAPI)的抗熒光淬滅劑染核并封片;熒光顯微鏡下觀察并采集圖像。
參照文獻[11]方法,實時熒光定量PCR(RT-PCR)檢測對照組、1.0 nmol/L組、10.0 nmol/L組細胞中CXCR4 mRNA的表達。Trizol一步法提取細胞總RNA,紫外分光光度計測定RNA純度,按逆轉錄試劑盒的操作說明逆轉錄合成cDNA,以cDNA為模板進行擴增,總反應體系為50 μl。采用Primer Premier5.0軟件設計引物。CXCR4:正向引物5’-GCATCGTCATCCTGTCCTGT-3’,反向引物5’-CGACGCTCTCGAACTCACAT-3’,擴增片段長度 204堿基對(bp);磷酸甘油醛脫氫酶(GAPDH):正向引物5’-CCGCATCTTCTTGTGCAGTG-3’,反向引物5’-ACCAGCTTCCCATTCTCAGC-3’,擴增片段長度239 bp。反應條件:95 ℃15 s,57 ℃30 s,74 ℃30 s;變性、退火、延伸重復45個循環形成擴增曲線,記錄循環閾值(Ct值),以GAPDH為內參基因,采用2?ΔΔCt法計算目的基因mRNA相對表達量。
參照文獻[12-13]方法,蛋白免疫印跡法(Western blot)檢測1.0 nmol/L組、10.0 nmol/L組細胞中CXCR4蛋白表達。BMSC中提取總蛋白,加入蛋白上樣緩沖液,95 ℃煮沸5 min。14%聚丙烯酰胺凝膠電泳,轉移到聚偏氟乙烯膜上,5%脫脂奶粉封閉2 h。加入鼠抗人CXCR4單克隆抗體一抗(1∶500)4 ℃過夜,含吐溫20的洗膜緩沖液(TBST)洗膜3次,10 min/次。加入辣根過氧化物酶標記的二抗(1∶2000),室溫下振搖2 h,TBST洗膜3次,10 min/次。超敏化學發光試劑盒顯色2 min,X光顯影。對CXCR4蛋白進行定量分析,蛋白條帶的灰度比值一目的蛋白CXCR4條帶灰度值/β-肌動蛋白(β-actin)條帶灰度值。
參照文獻[14]方法,Transwell小室法檢測1.0 nmol/L組、10.0 nmol/L組細胞的遷移能力。收集各組BMSC,每組24孔板下室加入600 μl含SDF-1濃度為100 ng/ml的無血清培養基,各組分別取5×104個BMSC的100 μl培養液注入上室;培養24 h后,去除濾膜上面的未移動細胞,40 g/L多聚甲醛固定,結晶紫染液染色,倒置顯微鏡下隨機選擇5個200倍視野計數遷移到底層的細胞。
?
SPSS16.0軟件行統計分析。數據以均數±標準差(
 ±s)表示。Probability- probability圖顯示各組數據呈近似正態分布,方差齊性檢驗顯示方差齊,組間比較行獨立樣本t檢驗。P<0.05為差異有統計學意義。
±s)表示。Probability- probability圖顯示各組數據呈近似正態分布,方差齊性檢驗顯示方差齊,組間比較行獨立樣本t檢驗。P<0.05為差異有統計學意義。
2 結果
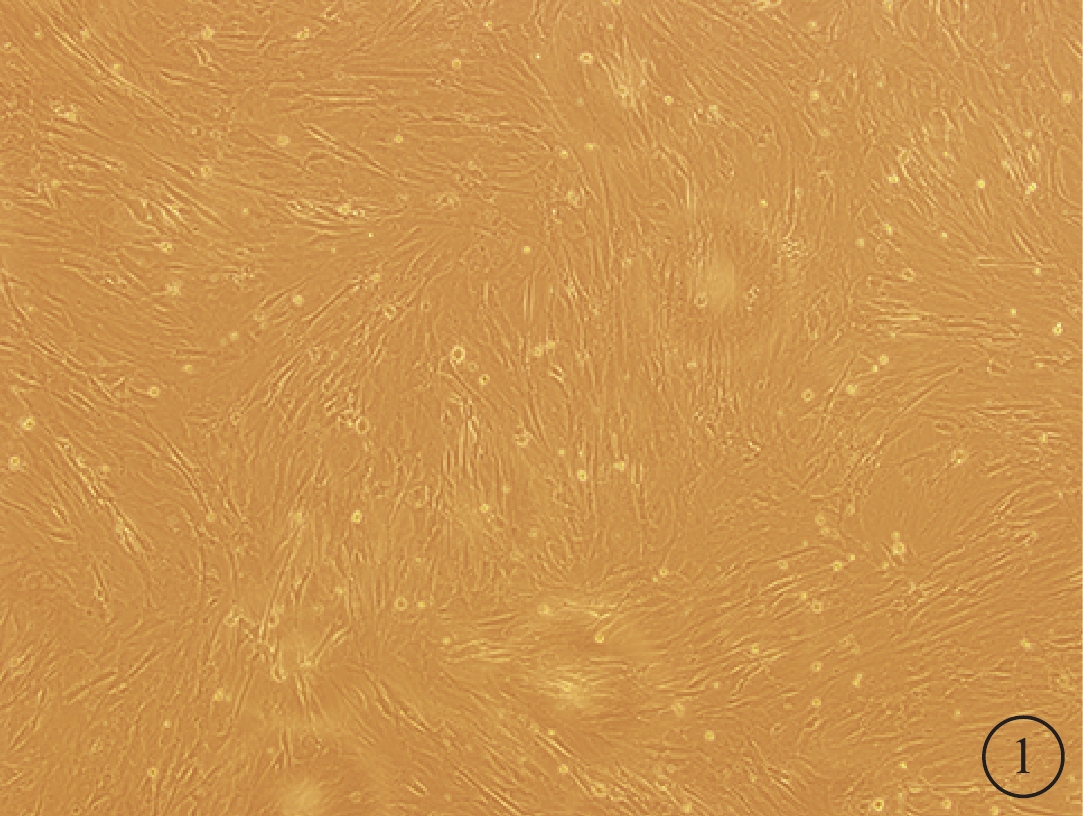
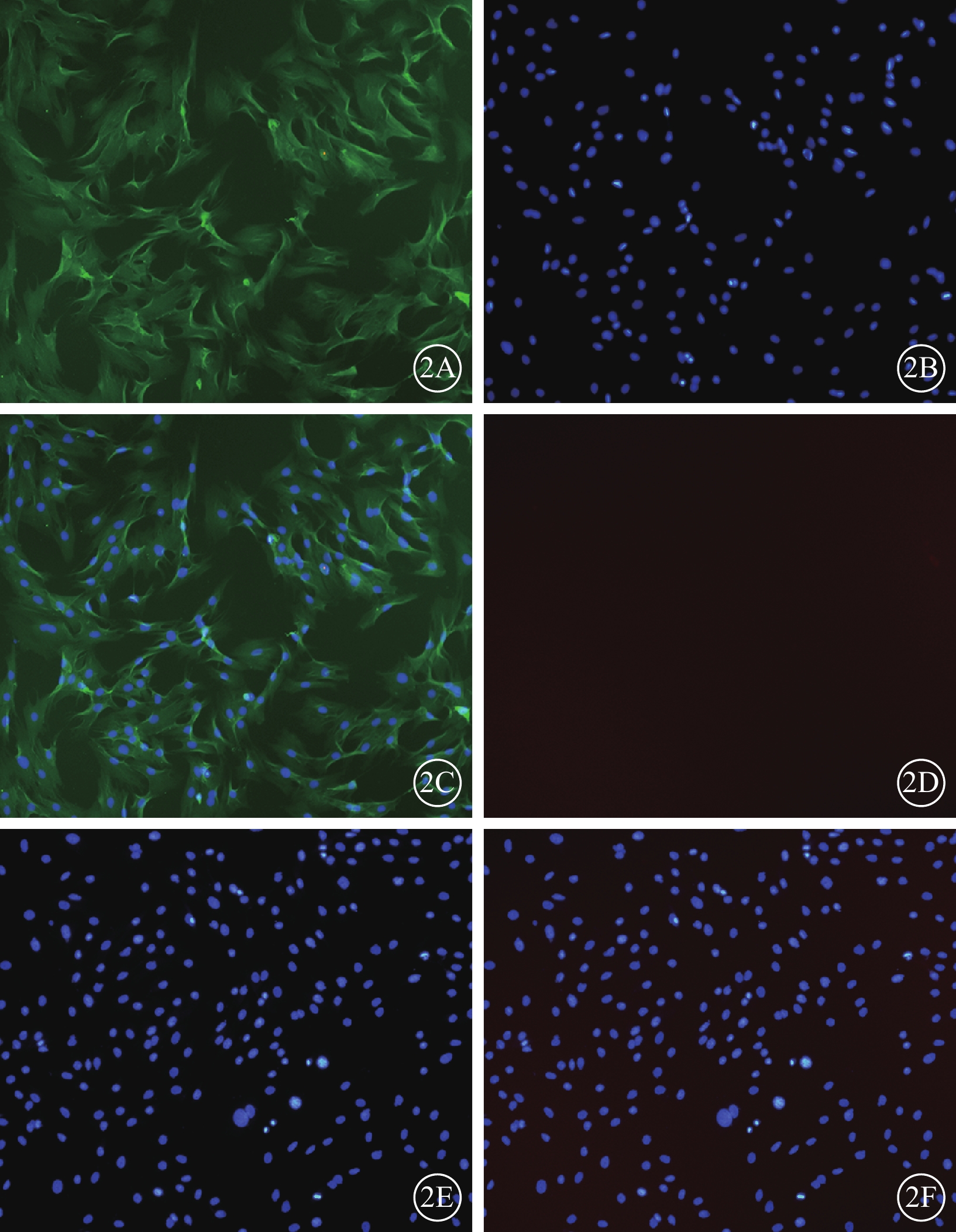
倒置相差異顯微鏡觀察發現,細胞培養開始時呈圓形,大小均一;4~5 h后部分開始貼壁生長,呈短梭形,散在分布,未貼壁細胞為圓形;5~7d后可見細胞呈長梭形,80%~90%融合,形態相對均一,呈漩渦狀生長(圖1)。免疫熒光檢測結果顯示,經過傳代純化的BMSC不表達CD11,而表達CD44(圖2)。流式細胞儀結果顯示細胞均表達CDl05、CD44和CD90,陽性率>95%;不表達CD34、CD45、CD11、CDl9和HLA-DR(HLA-Ⅱ),陽性率<2%。
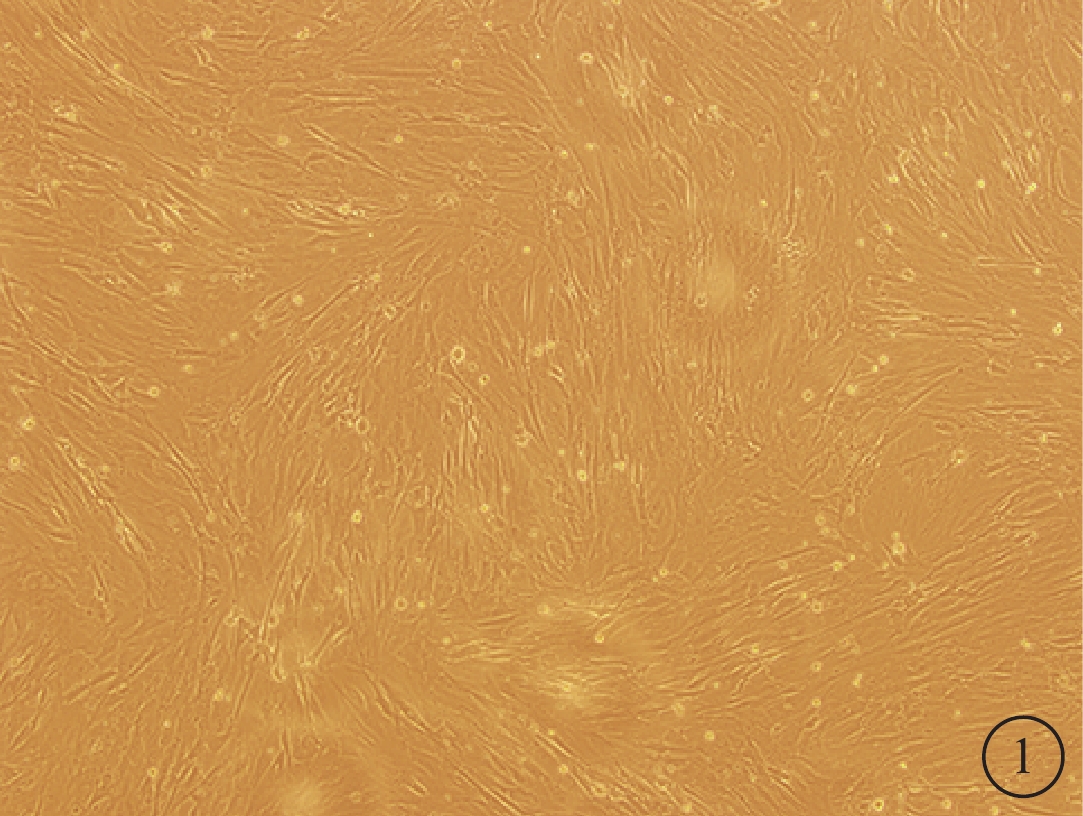 圖1
培養的BMSC倒置相差顯微鏡像。細胞呈長梭形,80%~90%融合,形態相對均一,呈漩渦狀生長×100
圖1
培養的BMSC倒置相差顯微鏡像。細胞呈長梭形,80%~90%融合,形態相對均一,呈漩渦狀生長×100
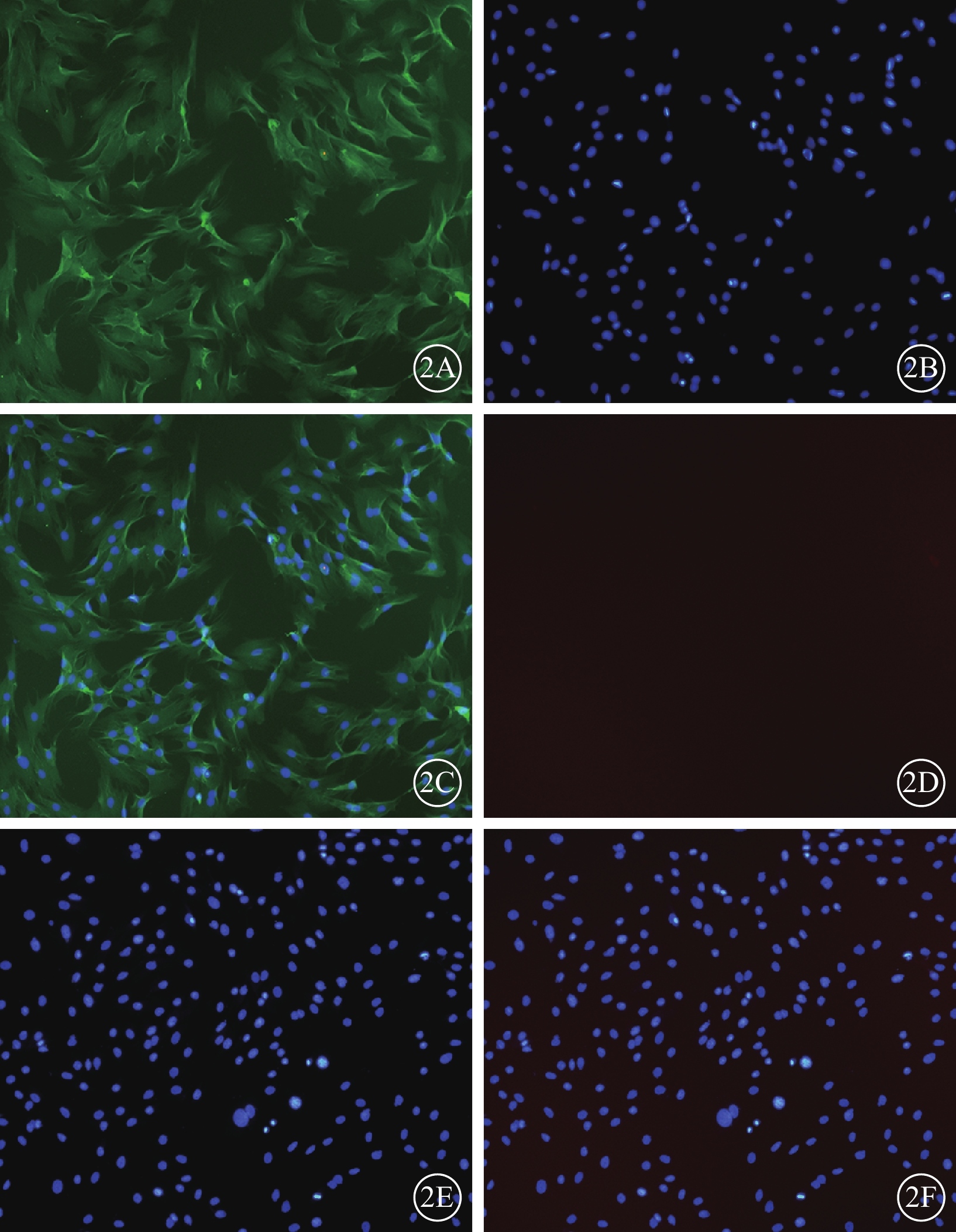 圖2
傳代純化的BMSC熒光顯微鏡像。2A.BMSC成梭型,胞漿豐富,CD44呈陽性表達,標記的胞質呈綠色熒光;2B.DAPI標記的細胞核呈藍色熒光;2C.共定位;2D.CD11呈陰性表達,胞質未見染色;2E.DAPI標記的細胞核呈藍色熒光;2F.共定位 ×200
圖2
傳代純化的BMSC熒光顯微鏡像。2A.BMSC成梭型,胞漿豐富,CD44呈陽性表達,標記的胞質呈綠色熒光;2B.DAPI標記的細胞核呈藍色熒光;2C.共定位;2D.CD11呈陰性表達,胞質未見染色;2E.DAPI標記的細胞核呈藍色熒光;2F.共定位 ×200
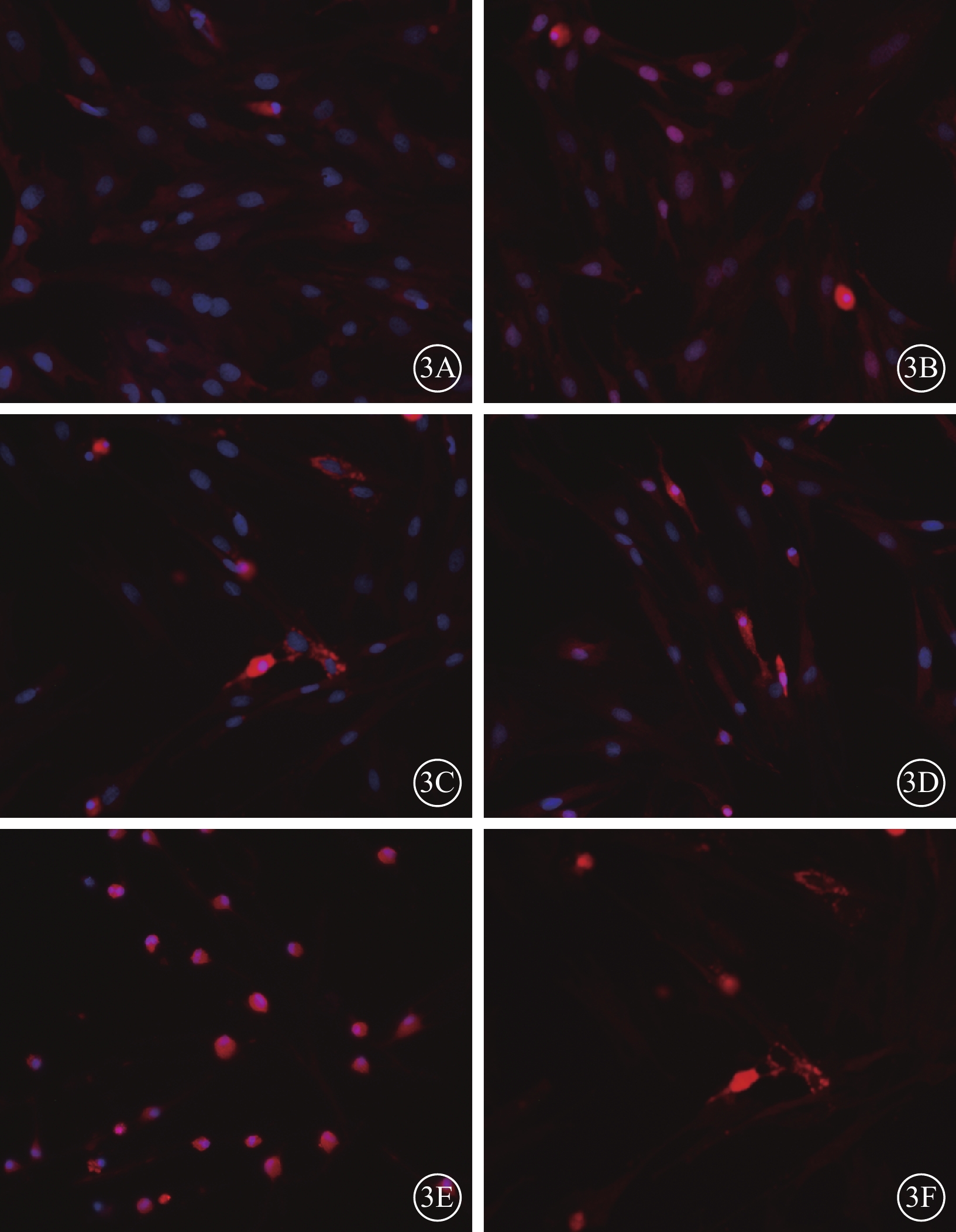
細胞免疫熒光法檢測結果顯示,ATV處理12 h后,對照組、0.1 nmol/L組、1.0 nmol/L組、10.0 nmol/L組細胞形態規則,胞質胞核明顯,CXCR4蛋白表達量隨ATV濃度升高而增加;100.0 nmol/L組、1 000.0 nmol/L組細胞可見CRCR4蛋白表達,但部分細胞破裂、死亡(圖3)。對照組和不同濃度組細胞中CXCR4相對熒光度分別為0.08、0.25、0.55、0.58、0.34、0.28;1.0 nmol/L組、10.0 nmol/L組細胞中CXCR4表達量最高。
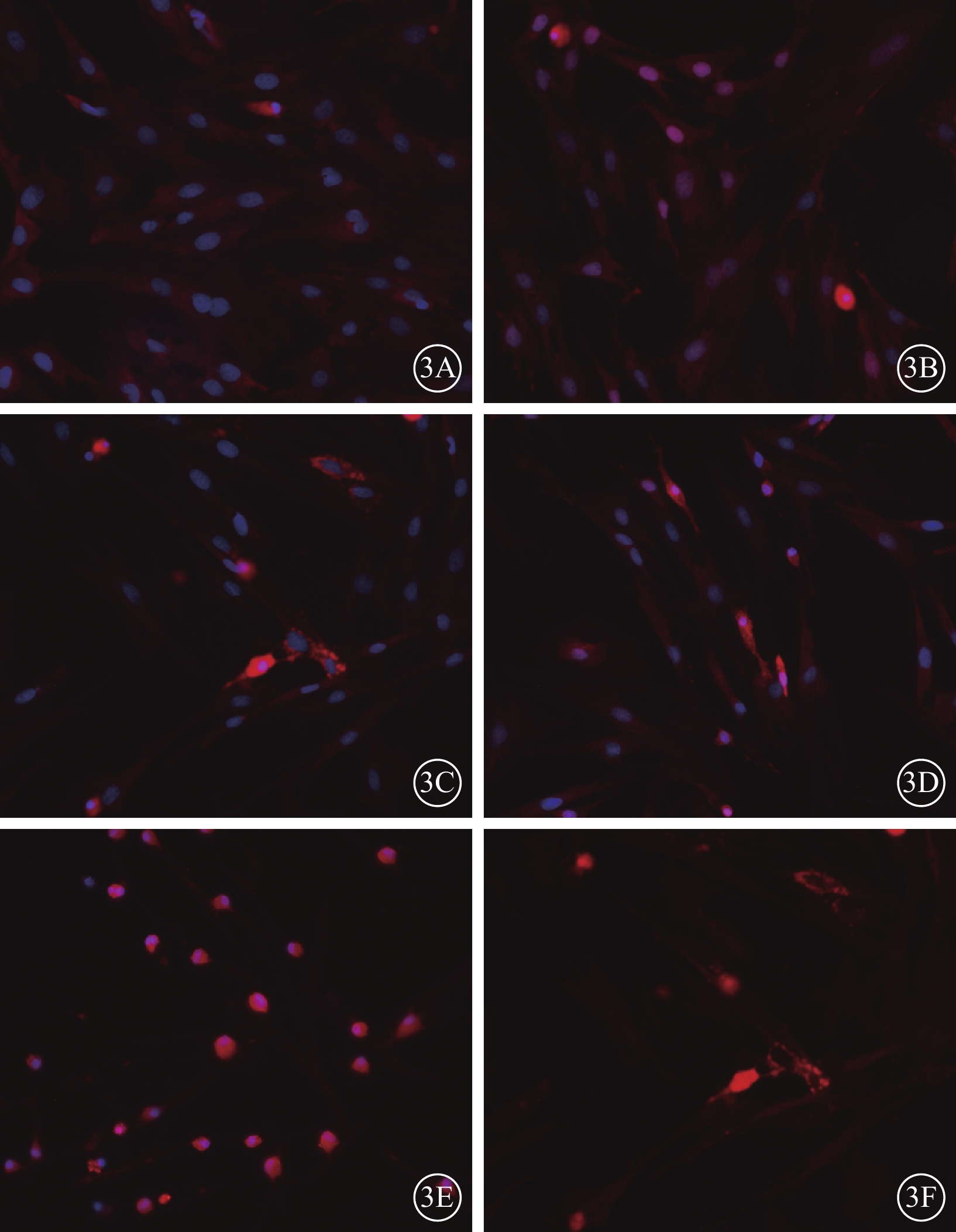 圖3
對照組和不同濃度組細胞熒光顯微鏡像。3A~3F.分別為對照組、0.1 nmol/L組、1.0 nmol/L組、10.0 nmol/L組、100.0 nmol/L組、1 000.0 nmol/L組。對照組、0.1 nmol/L組、1.0 nmol/L組細胞形態規則,胞質胞核清晰,胞核藍染與胞漿抗CXCR4蛋白陽性(紅色),抗CXCR4蛋白依ATV濃度升高呈遞增趨勢。10.0 nmol/L組、100.0 nmol/L組、1 000.0 nmol/L組細胞失去原有形態,部分變圓、破裂 ×200
圖3
對照組和不同濃度組細胞熒光顯微鏡像。3A~3F.分別為對照組、0.1 nmol/L組、1.0 nmol/L組、10.0 nmol/L組、100.0 nmol/L組、1 000.0 nmol/L組。對照組、0.1 nmol/L組、1.0 nmol/L組細胞形態規則,胞質胞核清晰,胞核藍染與胞漿抗CXCR4蛋白陽性(紅色),抗CXCR4蛋白依ATV濃度升高呈遞增趨勢。10.0 nmol/L組、100.0 nmol/L組、1 000.0 nmol/L組細胞失去原有形態,部分變圓、破裂 ×200
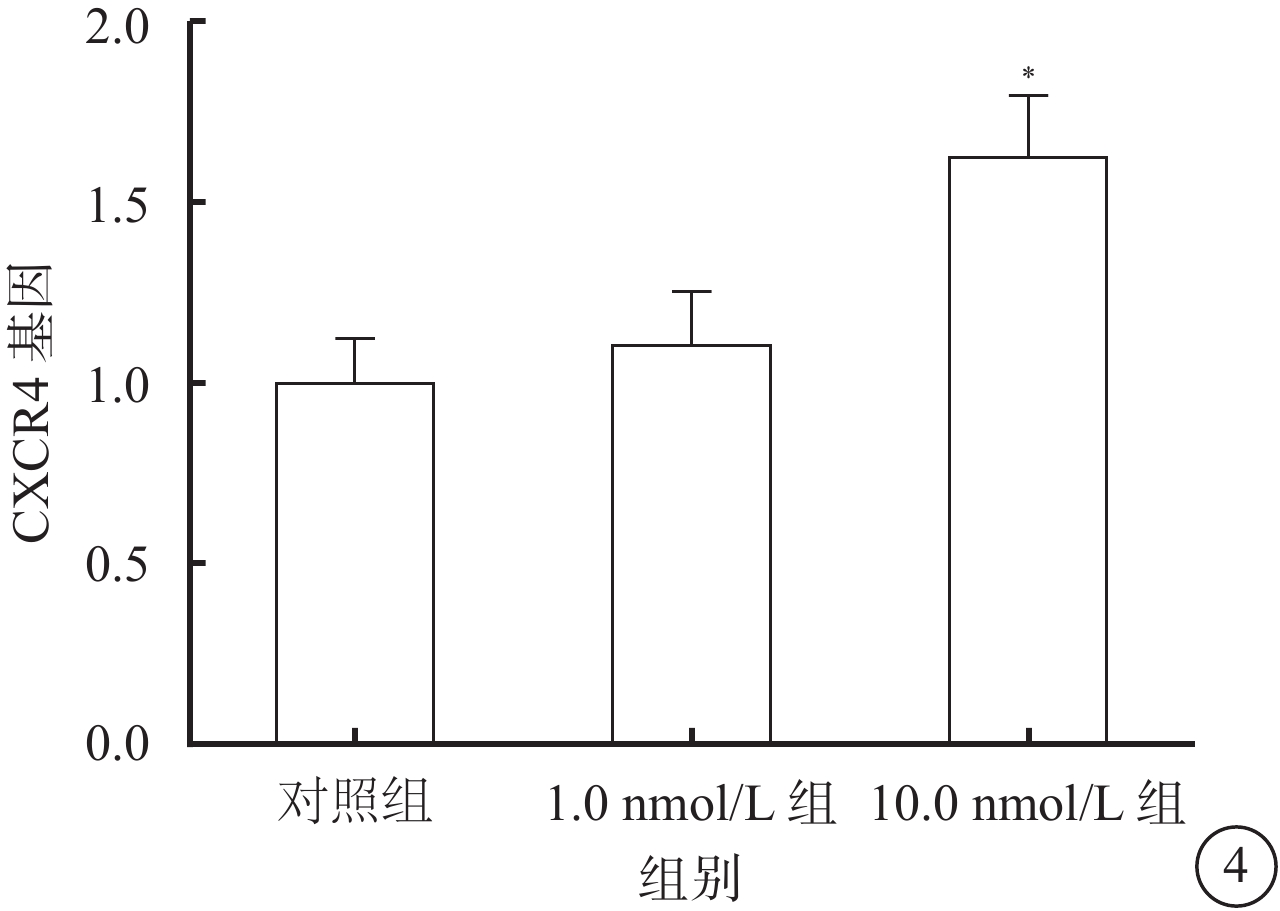
RT-PCR檢測結果顯示,10.0 nmol/L組細胞中CXCR4 mRNA表達較對照組、1.0 nmol/L組升高,差異有統計學意義(F=20.36,P=0.005);組間兩兩比較,10.0 nmol/L組與對照組、1.0 nmol/L組差異有統計學意義(t=6.89、5.83,P=0.000,0.003),1.0 nmol/L組與對照組差異無統計學意義(t=1.64,P=0.236)(圖4)。
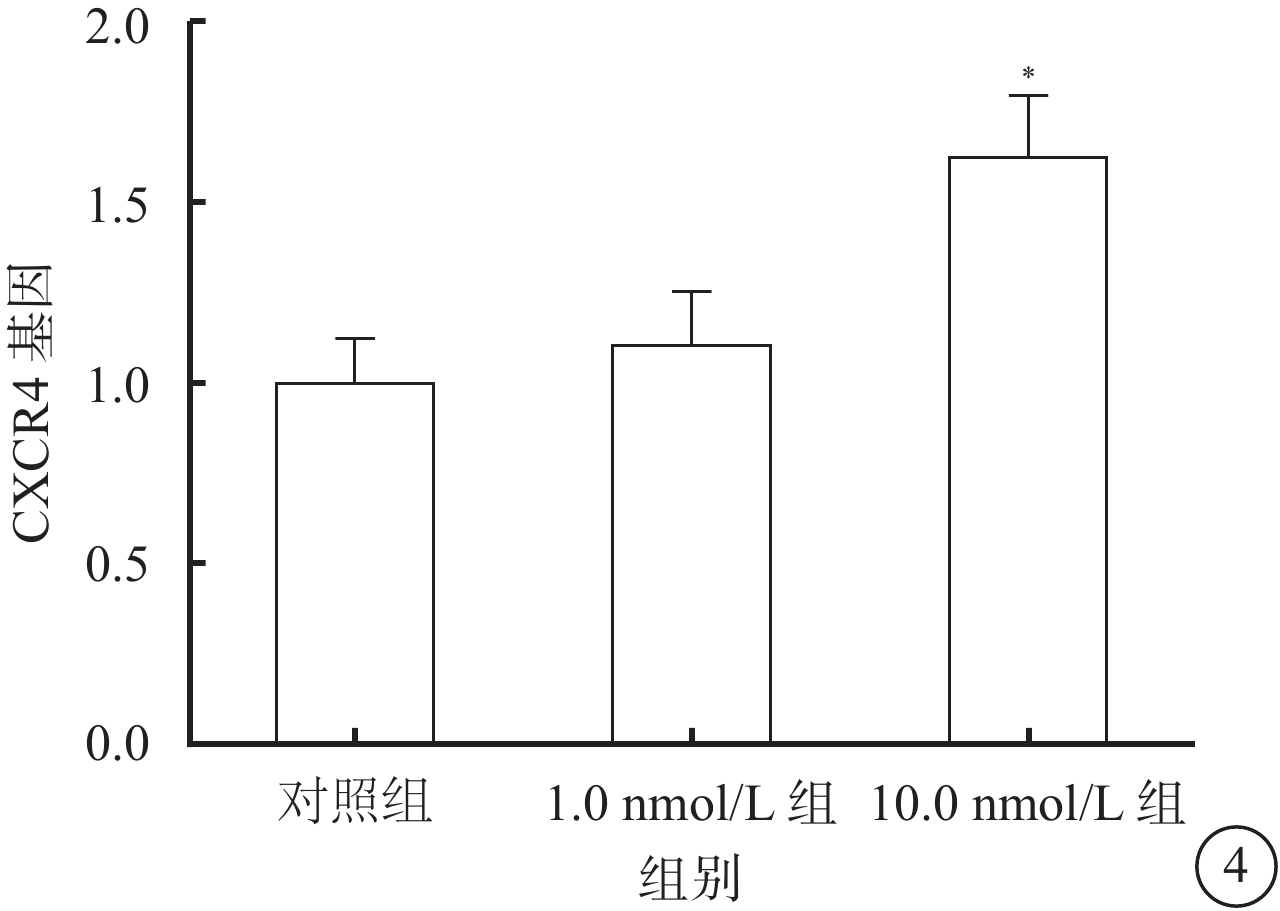 圖4
對照組、1.0 nmol/L組、10.0 nmol/L組細胞CXCR4 mRNA表達比較。*P<0.05
圖4
對照組、1.0 nmol/L組、10.0 nmol/L組細胞CXCR4 mRNA表達比較。*P<0.05
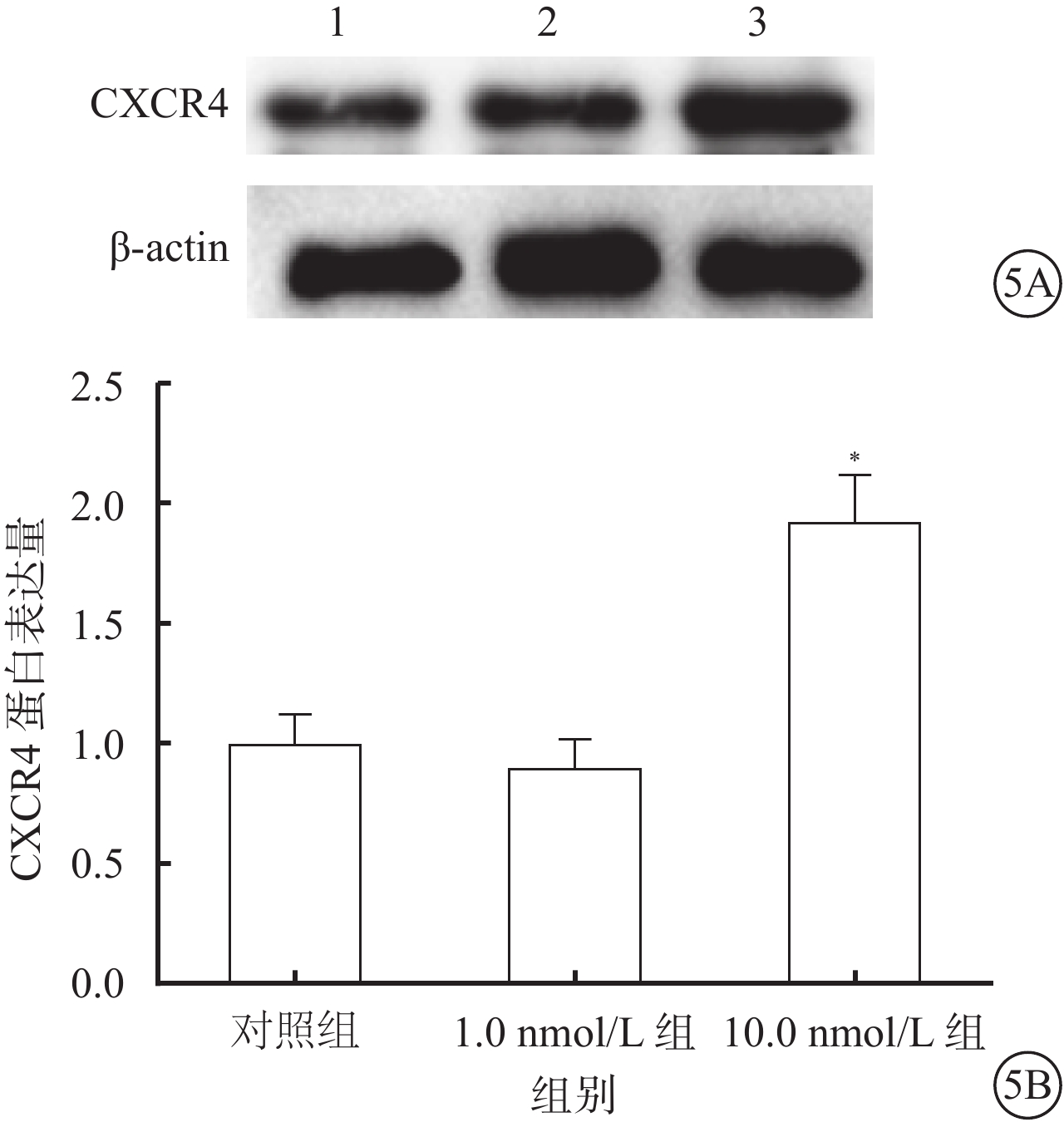
Western blot檢測結果顯示,10.0 nmol/L組細胞中CXCR4 蛋白表達較對照組、1.0 nmol/L組升高,差異有統計學意義(F=33.17,P=0.009);組間兩兩比較,10.0 nmol/L組與對照組、1.0 nmol/L組差異有統計學意義(t=4.74、5.37,P=0.007,0.011),1.0 nmol/L組與對照組差異無統計學意義(t=1.76,P=0.335)(圖5)。
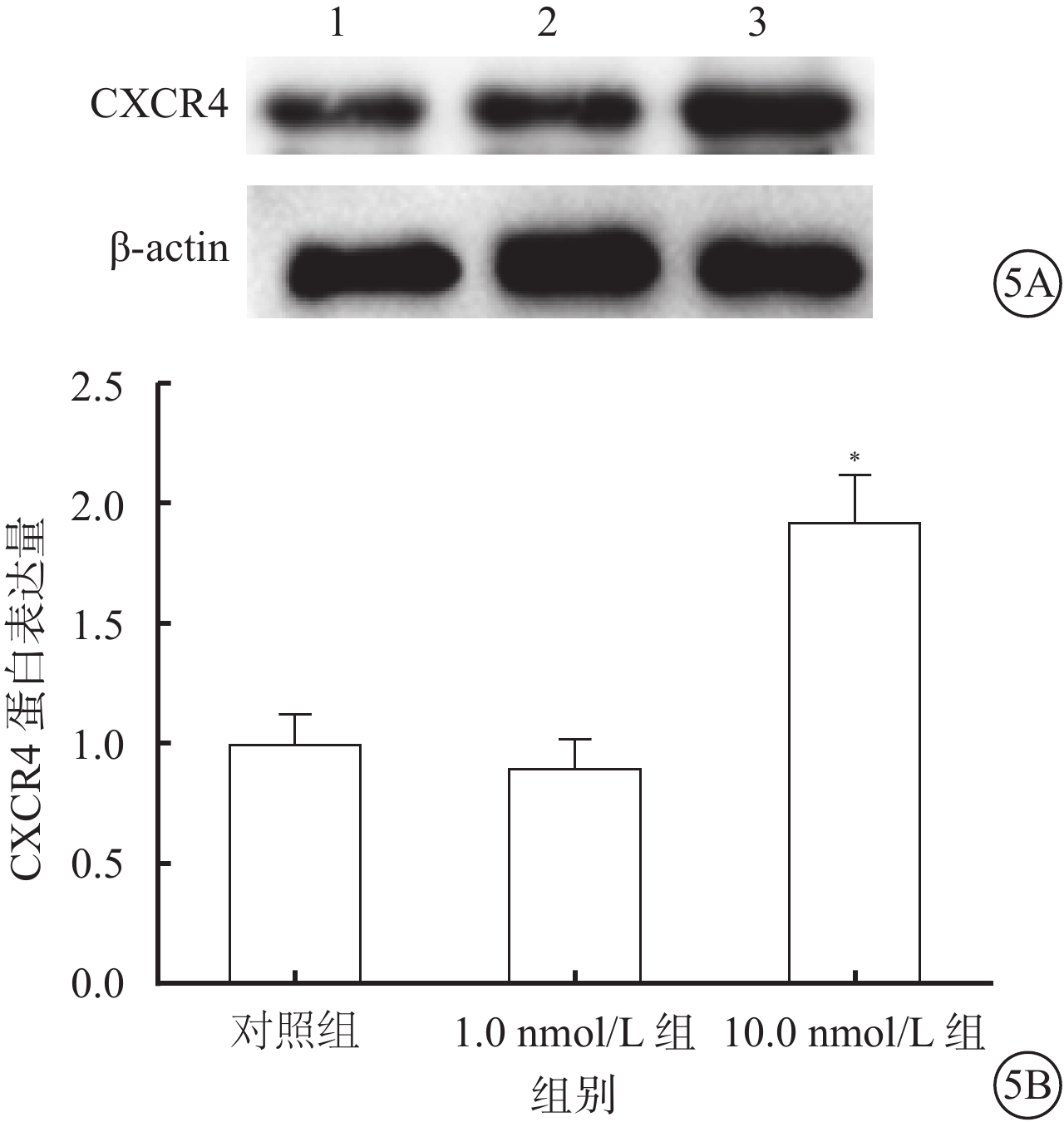 圖5
對照組、1.0 nmol/L組、10.0 nmol/L組細胞CXCR4蛋白表達情況。5A. 電泳圖,1~3分別為對照組、1.0 nmol/L組、10.0 nmol/L組;5B. 對照組、1.0 nmol/L組、10.0 nmol/L組細胞CXCR4蛋白表達結果。*P<0.05
圖5
對照組、1.0 nmol/L組、10.0 nmol/L組細胞CXCR4蛋白表達情況。5A. 電泳圖,1~3分別為對照組、1.0 nmol/L組、10.0 nmol/L組;5B. 對照組、1.0 nmol/L組、10.0 nmol/L組細胞CXCR4蛋白表達結果。*P<0.05
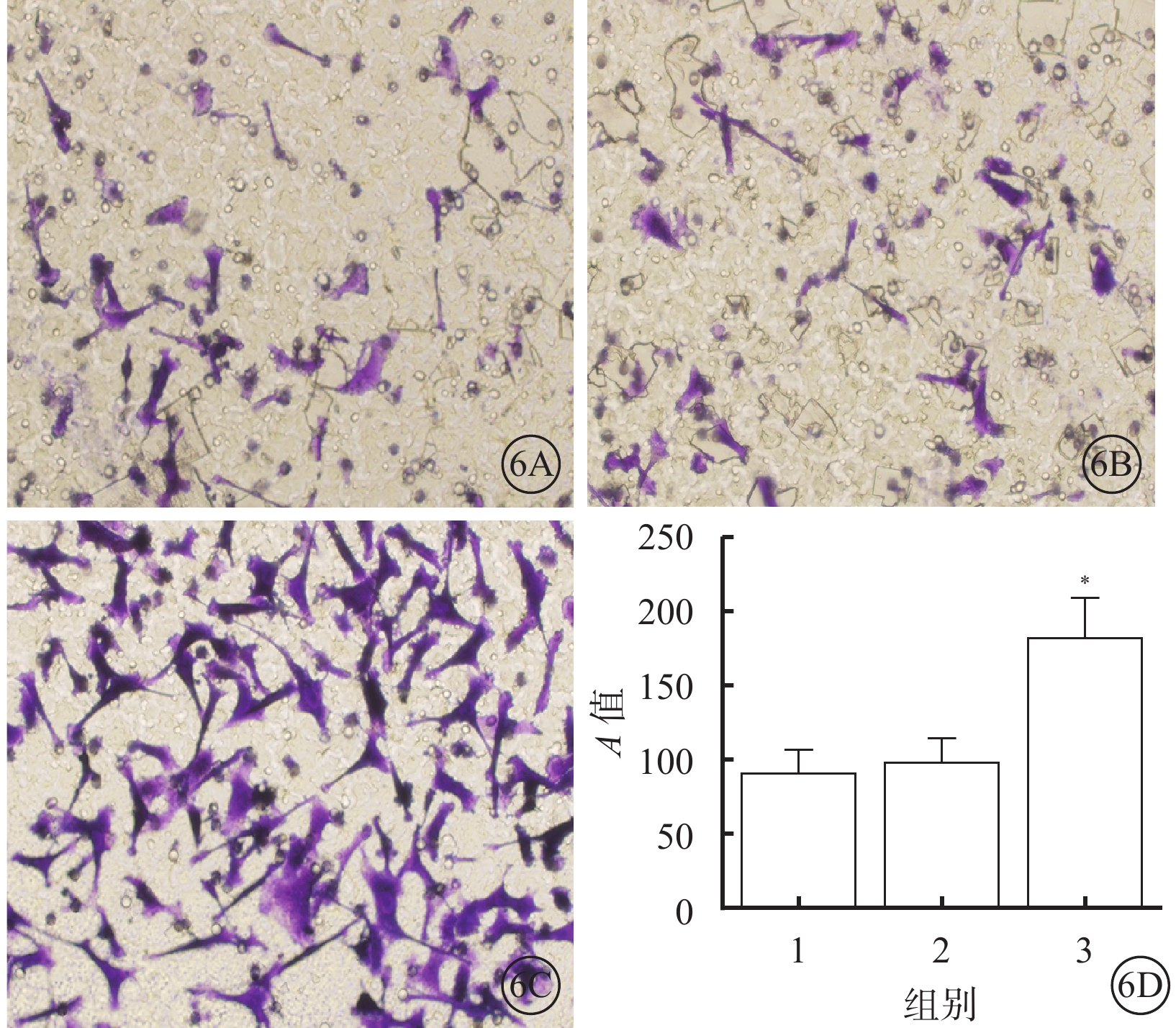
細胞遷移檢測結果顯示,10.0 nmol/L組細胞遷移能力較對照組和1.0 nmol/L組明顯增加,差異有統計學意義(F=43.77,P=0.000);組間兩兩比較,10.0 nmol/L組與對照組、1.0 nmol/L組差異有統計學意義(t=10.08、9.27,P=0.000,0.006),1.0 nmol/L組與對照組差異無統計學意義(t=1.74,P=0.439)(圖6)。
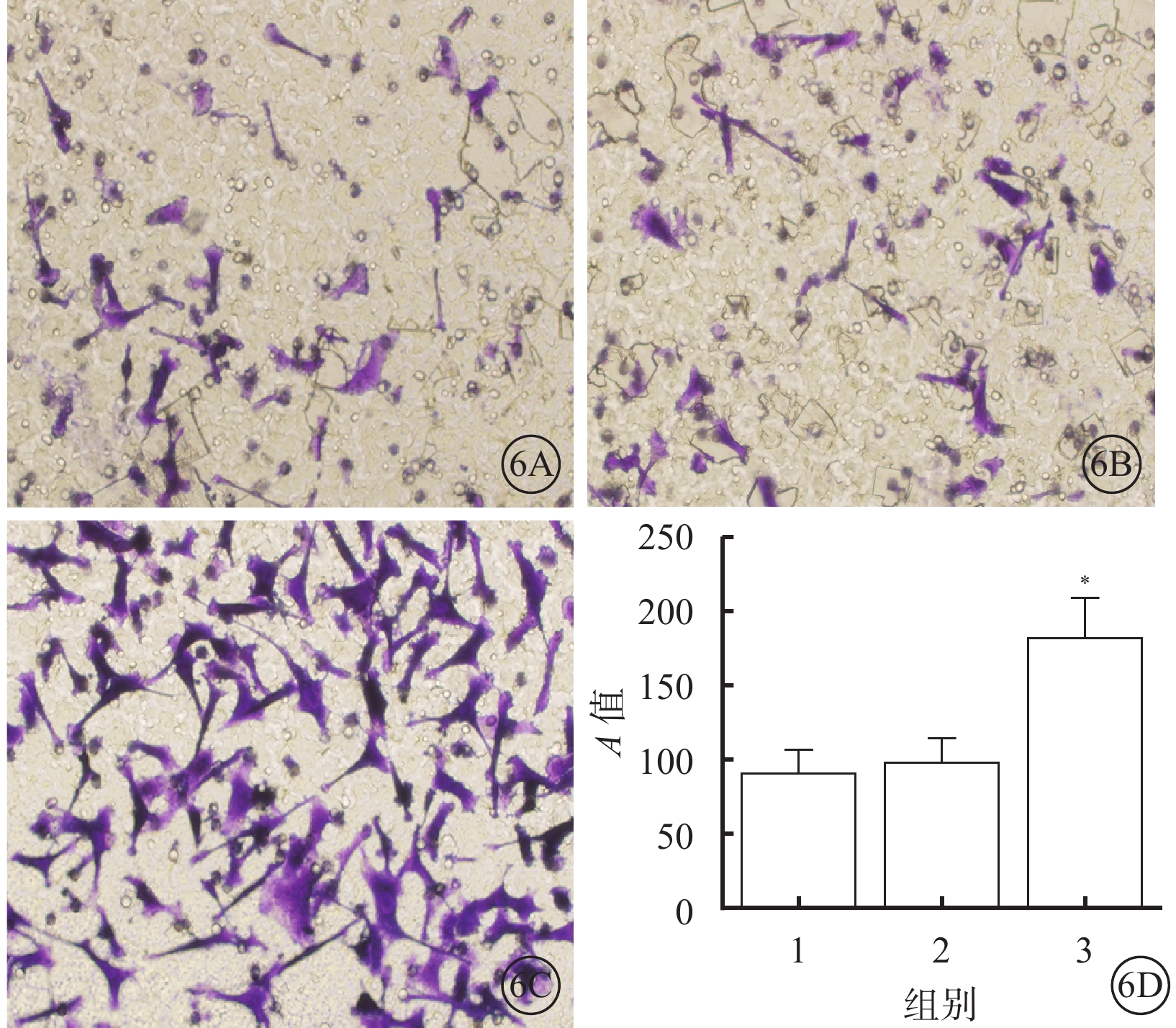 圖6
對照組、1.0 nmol/L組、10.0 nmol/L組細胞遷移情況。6A~6C. 分別為對照組、1.0 nmol/L組、10.0 nmol/L組細胞結晶紫染色結果,標尺:200 μm;6D. 細胞遷移結果比較,1~3分別為對照組、1.0 nmol/L組、10.0 nmol/L組 *P<0.05
圖6
對照組、1.0 nmol/L組、10.0 nmol/L組細胞遷移情況。6A~6C. 分別為對照組、1.0 nmol/L組、10.0 nmol/L組細胞結晶紫染色結果,標尺:200 μm;6D. 細胞遷移結果比較,1~3分別為對照組、1.0 nmol/L組、10.0 nmol/L組 *P<0.05
3 討論
BMSC在免疫調節、抗凋亡、抗炎以及促血管生成因子、趨化或刺激組織再生的方面具有顯著效果,并具有分泌多種生物活性分子的能力[15]。目前BMSC是治療視網膜變性類疾病的理想種子細胞,但大多數輸注的BMSC無法到達靶器官,治療效果較差。所以提高干細胞歸巢是應用BMSC治療疾病的關鍵。研究表明,BMSC的遷移主要受SDF-1/CXCR4信號通路調控[16]。組織損傷后,SDF-1在受損部位的表達上調,使局部SDF-1的濃度升高并向周圍擴散,表面表達CXCR4的干細胞順著SDF-1的濃度梯度到達損傷部分定植及修復組織[8]。本研究結果顯示,ATV處理BMSC后,發現其能夠促進BMSC內CRCX4因子表達并提高其遷移能力。此結果證實ATV處理BMSC以增強其遷移歸巢能力的可行性,可為進一步研究BMSC對DR治療作用提供實驗基礎。
他汀類藥物即羥甲基戊二酰輔酶A還原酶抑制劑,是目前臨床應用廣泛的降脂藥物,具有抗凋亡、保護內皮功能及抗炎、抗氧化、促進新生血管生成等作用[17]。他汀類藥物可有效提高eNOS活性,Nakanishi等[18]研究顯示,阿托伐他汀通過腺苷酸活化蛋白激酶B、eNOS途徑,保護MSC免受缺氧及脫離血清的損傷,提高生存能力。Li等[19]研究表明,利用ATV處理BMSC,可以提高細胞表面CXCR4的表達,進而增強細胞的遷移和歸巢能力;并通過改善梗死心肌中炎性因子的表達,進一步改善心肌梗死后心功能。本研究結果顯示,ATV處理BMSC最佳處理時間為12 h,與Li等[19]的研究結果一致。本研究顯示處理時間超過12 h,BMSC大量死亡,狀態明顯下降,不適合繼續延長處理時間,ATV的最佳處理濃度為10.0 nmol/L,ATV促使BMSC的CXCR4表達增加呈劑量依賴性,但過高濃度ATV會導致細胞狀態欠佳甚至死亡,也會使CXCR4的表達下降,與張惟等[20]采用辛伐他汀處理內皮祖細胞以提高其黏附、遷移功能的研究結果一致。其原因可能與藥物的雙相效應有關,或過高濃度的他汀類藥物對細胞具有一定的毒副作用。
本研究通過探索ATV處理BMSC,以增強BMSC遷移體外能力,發現ATV處理BMSC后,其與細胞遷移密切相關的CXCR4表達明顯增加,可能是未來治療DR的一種新途徑。但本研究僅為體外實驗,未進行相關體內實驗,且ATV處理BMSC后未進行其增生及凋亡的檢測,對處理后的BMSC細胞質量及細胞安全性等問題均有待進一步探討和研究。
糖尿病視網膜病變(DR)是工作年齡人群致盲的首要原因[1]。間充質干細胞(MSC)具有多向分化潛能、低免疫原性和免疫赦免等特性[2-3],被廣泛應用于多種疾病的預防和治療。近年來,MSC移植治療DR表現出良好的應用前景[4],但其存在體內存活率低、分化效率低、歸巢能力差的缺點[5-7]。據報道,基質細胞衍生因子-1(SDF-1)/CXC趨化因子受體4(CXCR4)信號通路在MSC的歸巢、趨化,黏附分子的表達和植入中發揮重要作用[8]。研究表明,阿托伐他汀(ATV)可以使腺苷磷酸(AMP)蛋白激酶磷酸化水平顯著升高,誘導內皮型一氧化氮合酶(eNOS)上調,一氧化氮的合成增加,這可能導致CXCR4的表達增加,促進歸巢[9-10]。本研究應用ATV處理的大鼠骨髓MSC(BMSC),初步探討通過藥物處理BMSC以增強其遷移歸巢能力的可行性,為研究BMSC對DR治療作用提供實驗基礎。現將結果報道如下。
1 材料和方法
?
抗原分化簇(CD)(美國BD公司);Polybrene(美國Santa Cruze公司);總RNA提取試劑盒(北京賽百盛基因技術有限公司);CXCR4單克隆抗體(美國Invitrogen公司);dNTP(美國Invitrogen公司);聚合酶鏈(PCR)引物(北京奧科生物技術有限公司);SYBR Premix Ex Taq Ⅰ、RNA酶抑制劑、脫氧核糖核酸Marker DL2000、TaqDNA聚合酶、Oligo Dt primer、DNA marker(日本Takara公司);M-MLV cDNA合成試劑盒(美國Invitrogen公司);熒光倒置顯微鏡(日本Olympus公司);熒光定量PCR儀(德國Eppendorf公司);酶標儀(美國Thermo公司)。
?
雌性Sprague Dawley大鼠12只,4~6周齡,體重80~100 g,無特定病原體級。天津醫科大學實驗動物科學部提供;實驗動物的使用符合國家科學技術委員會頒布的《實驗動物管理條例》。大鼠處死后無菌條件下取出雙側股骨、脛骨。Dubecoo改良Eagle(DMEM)培養基/F12培養液沖洗骨髓腔,將沖洗出的骨髓腔內容物室溫下離心,離心半徑10 cm,800 r/min離心5 min,棄上清。加入含10%胎牛血清的DMEM/F12培養液重懸細胞,接種至75 CIll2培養瓶中,37℃、5% CO2、飽和濕度下常規培養。48 h后首次換液.之后每72 h換液1次。細胞融合至80%以上后,按1∶2~1∶3傳代。倒置相差顯微鏡觀察細胞形態變化。細胞免疫熒光法檢測第4~6代BMSC表面分子CD11、CD44,鑒定BMSC。流式細胞儀檢測4~6代BMSC表面分子CD44、CD19、CD34等,鑒定BMSC。細胞培養至第4~6代時,重懸細胞使其濃度為1×105個/ml,37℃、5% CO2培養12 h后貼壁,在培養液中分別加入終濃度為0.0、0.1、1.0、10.0、100.0、1 000.0 nmol/L的ATV,處理BMSC 12 h;并據此分組,0.0 nmol/L組為對照組,余為不同濃度實驗組。
細胞免疫熒光法檢測不同濃度組細胞中CXCR4蛋白表達情況。收集培養貼壁的BMSC,調整細胞濃度為2×105個/L,加入4%多聚甲醛固定20 min;除去多聚甲醛,0.3%Triton X-100室溫通透20 min;除去Triton X-100,5%牛血清白蛋白封閉1 h;滴加足夠量適宜濃度的一抗CXCR4,4℃孵育過夜;除去一抗,滴加足夠量適宜濃度的二抗,37℃,30 min;除去二抗;滴加一滴含4',6-二脒基-2-苯基吲哚(DAPI)的抗熒光淬滅劑染核并封片;熒光顯微鏡下觀察并采集圖像。
參照文獻[11]方法,實時熒光定量PCR(RT-PCR)檢測對照組、1.0 nmol/L組、10.0 nmol/L組細胞中CXCR4 mRNA的表達。Trizol一步法提取細胞總RNA,紫外分光光度計測定RNA純度,按逆轉錄試劑盒的操作說明逆轉錄合成cDNA,以cDNA為模板進行擴增,總反應體系為50 μl。采用Primer Premier5.0軟件設計引物。CXCR4:正向引物5’-GCATCGTCATCCTGTCCTGT-3’,反向引物5’-CGACGCTCTCGAACTCACAT-3’,擴增片段長度 204堿基對(bp);磷酸甘油醛脫氫酶(GAPDH):正向引物5’-CCGCATCTTCTTGTGCAGTG-3’,反向引物5’-ACCAGCTTCCCATTCTCAGC-3’,擴增片段長度239 bp。反應條件:95 ℃15 s,57 ℃30 s,74 ℃30 s;變性、退火、延伸重復45個循環形成擴增曲線,記錄循環閾值(Ct值),以GAPDH為內參基因,采用2?ΔΔCt法計算目的基因mRNA相對表達量。
參照文獻[12-13]方法,蛋白免疫印跡法(Western blot)檢測1.0 nmol/L組、10.0 nmol/L組細胞中CXCR4蛋白表達。BMSC中提取總蛋白,加入蛋白上樣緩沖液,95 ℃煮沸5 min。14%聚丙烯酰胺凝膠電泳,轉移到聚偏氟乙烯膜上,5%脫脂奶粉封閉2 h。加入鼠抗人CXCR4單克隆抗體一抗(1∶500)4 ℃過夜,含吐溫20的洗膜緩沖液(TBST)洗膜3次,10 min/次。加入辣根過氧化物酶標記的二抗(1∶2000),室溫下振搖2 h,TBST洗膜3次,10 min/次。超敏化學發光試劑盒顯色2 min,X光顯影。對CXCR4蛋白進行定量分析,蛋白條帶的灰度比值一目的蛋白CXCR4條帶灰度值/β-肌動蛋白(β-actin)條帶灰度值。
參照文獻[14]方法,Transwell小室法檢測1.0 nmol/L組、10.0 nmol/L組細胞的遷移能力。收集各組BMSC,每組24孔板下室加入600 μl含SDF-1濃度為100 ng/ml的無血清培養基,各組分別取5×104個BMSC的100 μl培養液注入上室;培養24 h后,去除濾膜上面的未移動細胞,40 g/L多聚甲醛固定,結晶紫染液染色,倒置顯微鏡下隨機選擇5個200倍視野計數遷移到底層的細胞。
?
SPSS16.0軟件行統計分析。數據以均數±標準差(
 ±s)表示。Probability- probability圖顯示各組數據呈近似正態分布,方差齊性檢驗顯示方差齊,組間比較行獨立樣本t檢驗。P<0.05為差異有統計學意義。
±s)表示。Probability- probability圖顯示各組數據呈近似正態分布,方差齊性檢驗顯示方差齊,組間比較行獨立樣本t檢驗。P<0.05為差異有統計學意義。
2 結果
倒置相差異顯微鏡觀察發現,細胞培養開始時呈圓形,大小均一;4~5 h后部分開始貼壁生長,呈短梭形,散在分布,未貼壁細胞為圓形;5~7d后可見細胞呈長梭形,80%~90%融合,形態相對均一,呈漩渦狀生長(圖1)。免疫熒光檢測結果顯示,經過傳代純化的BMSC不表達CD11,而表達CD44(圖2)。流式細胞儀結果顯示細胞均表達CDl05、CD44和CD90,陽性率>95%;不表達CD34、CD45、CD11、CDl9和HLA-DR(HLA-Ⅱ),陽性率<2%。
 圖1
培養的BMSC倒置相差顯微鏡像。細胞呈長梭形,80%~90%融合,形態相對均一,呈漩渦狀生長×100
圖1
培養的BMSC倒置相差顯微鏡像。細胞呈長梭形,80%~90%融合,形態相對均一,呈漩渦狀生長×100
 圖2
傳代純化的BMSC熒光顯微鏡像。2A.BMSC成梭型,胞漿豐富,CD44呈陽性表達,標記的胞質呈綠色熒光;2B.DAPI標記的細胞核呈藍色熒光;2C.共定位;2D.CD11呈陰性表達,胞質未見染色;2E.DAPI標記的細胞核呈藍色熒光;2F.共定位 ×200
圖2
傳代純化的BMSC熒光顯微鏡像。2A.BMSC成梭型,胞漿豐富,CD44呈陽性表達,標記的胞質呈綠色熒光;2B.DAPI標記的細胞核呈藍色熒光;2C.共定位;2D.CD11呈陰性表達,胞質未見染色;2E.DAPI標記的細胞核呈藍色熒光;2F.共定位 ×200
細胞免疫熒光法檢測結果顯示,ATV處理12 h后,對照組、0.1 nmol/L組、1.0 nmol/L組、10.0 nmol/L組細胞形態規則,胞質胞核明顯,CXCR4蛋白表達量隨ATV濃度升高而增加;100.0 nmol/L組、1 000.0 nmol/L組細胞可見CRCR4蛋白表達,但部分細胞破裂、死亡(圖3)。對照組和不同濃度組細胞中CXCR4相對熒光度分別為0.08、0.25、0.55、0.58、0.34、0.28;1.0 nmol/L組、10.0 nmol/L組細胞中CXCR4表達量最高。
 圖3
對照組和不同濃度組細胞熒光顯微鏡像。3A~3F.分別為對照組、0.1 nmol/L組、1.0 nmol/L組、10.0 nmol/L組、100.0 nmol/L組、1 000.0 nmol/L組。對照組、0.1 nmol/L組、1.0 nmol/L組細胞形態規則,胞質胞核清晰,胞核藍染與胞漿抗CXCR4蛋白陽性(紅色),抗CXCR4蛋白依ATV濃度升高呈遞增趨勢。10.0 nmol/L組、100.0 nmol/L組、1 000.0 nmol/L組細胞失去原有形態,部分變圓、破裂 ×200
圖3
對照組和不同濃度組細胞熒光顯微鏡像。3A~3F.分別為對照組、0.1 nmol/L組、1.0 nmol/L組、10.0 nmol/L組、100.0 nmol/L組、1 000.0 nmol/L組。對照組、0.1 nmol/L組、1.0 nmol/L組細胞形態規則,胞質胞核清晰,胞核藍染與胞漿抗CXCR4蛋白陽性(紅色),抗CXCR4蛋白依ATV濃度升高呈遞增趨勢。10.0 nmol/L組、100.0 nmol/L組、1 000.0 nmol/L組細胞失去原有形態,部分變圓、破裂 ×200
RT-PCR檢測結果顯示,10.0 nmol/L組細胞中CXCR4 mRNA表達較對照組、1.0 nmol/L組升高,差異有統計學意義(F=20.36,P=0.005);組間兩兩比較,10.0 nmol/L組與對照組、1.0 nmol/L組差異有統計學意義(t=6.89、5.83,P=0.000,0.003),1.0 nmol/L組與對照組差異無統計學意義(t=1.64,P=0.236)(圖4)。
 圖4
對照組、1.0 nmol/L組、10.0 nmol/L組細胞CXCR4 mRNA表達比較。*P<0.05
圖4
對照組、1.0 nmol/L組、10.0 nmol/L組細胞CXCR4 mRNA表達比較。*P<0.05
Western blot檢測結果顯示,10.0 nmol/L組細胞中CXCR4 蛋白表達較對照組、1.0 nmol/L組升高,差異有統計學意義(F=33.17,P=0.009);組間兩兩比較,10.0 nmol/L組與對照組、1.0 nmol/L組差異有統計學意義(t=4.74、5.37,P=0.007,0.011),1.0 nmol/L組與對照組差異無統計學意義(t=1.76,P=0.335)(圖5)。
 圖5
對照組、1.0 nmol/L組、10.0 nmol/L組細胞CXCR4蛋白表達情況。5A. 電泳圖,1~3分別為對照組、1.0 nmol/L組、10.0 nmol/L組;5B. 對照組、1.0 nmol/L組、10.0 nmol/L組細胞CXCR4蛋白表達結果。*P<0.05
圖5
對照組、1.0 nmol/L組、10.0 nmol/L組細胞CXCR4蛋白表達情況。5A. 電泳圖,1~3分別為對照組、1.0 nmol/L組、10.0 nmol/L組;5B. 對照組、1.0 nmol/L組、10.0 nmol/L組細胞CXCR4蛋白表達結果。*P<0.05
細胞遷移檢測結果顯示,10.0 nmol/L組細胞遷移能力較對照組和1.0 nmol/L組明顯增加,差異有統計學意義(F=43.77,P=0.000);組間兩兩比較,10.0 nmol/L組與對照組、1.0 nmol/L組差異有統計學意義(t=10.08、9.27,P=0.000,0.006),1.0 nmol/L組與對照組差異無統計學意義(t=1.74,P=0.439)(圖6)。
 圖6
對照組、1.0 nmol/L組、10.0 nmol/L組細胞遷移情況。6A~6C. 分別為對照組、1.0 nmol/L組、10.0 nmol/L組細胞結晶紫染色結果,標尺:200 μm;6D. 細胞遷移結果比較,1~3分別為對照組、1.0 nmol/L組、10.0 nmol/L組 *P<0.05
圖6
對照組、1.0 nmol/L組、10.0 nmol/L組細胞遷移情況。6A~6C. 分別為對照組、1.0 nmol/L組、10.0 nmol/L組細胞結晶紫染色結果,標尺:200 μm;6D. 細胞遷移結果比較,1~3分別為對照組、1.0 nmol/L組、10.0 nmol/L組 *P<0.05
3 討論
BMSC在免疫調節、抗凋亡、抗炎以及促血管生成因子、趨化或刺激組織再生的方面具有顯著效果,并具有分泌多種生物活性分子的能力[15]。目前BMSC是治療視網膜變性類疾病的理想種子細胞,但大多數輸注的BMSC無法到達靶器官,治療效果較差。所以提高干細胞歸巢是應用BMSC治療疾病的關鍵。研究表明,BMSC的遷移主要受SDF-1/CXCR4信號通路調控[16]。組織損傷后,SDF-1在受損部位的表達上調,使局部SDF-1的濃度升高并向周圍擴散,表面表達CXCR4的干細胞順著SDF-1的濃度梯度到達損傷部分定植及修復組織[8]。本研究結果顯示,ATV處理BMSC后,發現其能夠促進BMSC內CRCX4因子表達并提高其遷移能力。此結果證實ATV處理BMSC以增強其遷移歸巢能力的可行性,可為進一步研究BMSC對DR治療作用提供實驗基礎。
他汀類藥物即羥甲基戊二酰輔酶A還原酶抑制劑,是目前臨床應用廣泛的降脂藥物,具有抗凋亡、保護內皮功能及抗炎、抗氧化、促進新生血管生成等作用[17]。他汀類藥物可有效提高eNOS活性,Nakanishi等[18]研究顯示,阿托伐他汀通過腺苷酸活化蛋白激酶B、eNOS途徑,保護MSC免受缺氧及脫離血清的損傷,提高生存能力。Li等[19]研究表明,利用ATV處理BMSC,可以提高細胞表面CXCR4的表達,進而增強細胞的遷移和歸巢能力;并通過改善梗死心肌中炎性因子的表達,進一步改善心肌梗死后心功能。本研究結果顯示,ATV處理BMSC最佳處理時間為12 h,與Li等[19]的研究結果一致。本研究顯示處理時間超過12 h,BMSC大量死亡,狀態明顯下降,不適合繼續延長處理時間,ATV的最佳處理濃度為10.0 nmol/L,ATV促使BMSC的CXCR4表達增加呈劑量依賴性,但過高濃度ATV會導致細胞狀態欠佳甚至死亡,也會使CXCR4的表達下降,與張惟等[20]采用辛伐他汀處理內皮祖細胞以提高其黏附、遷移功能的研究結果一致。其原因可能與藥物的雙相效應有關,或過高濃度的他汀類藥物對細胞具有一定的毒副作用。
本研究通過探索ATV處理BMSC,以增強BMSC遷移體外能力,發現ATV處理BMSC后,其與細胞遷移密切相關的CXCR4表達明顯增加,可能是未來治療DR的一種新途徑。但本研究僅為體外實驗,未進行相關體內實驗,且ATV處理BMSC后未進行其增生及凋亡的檢測,對處理后的BMSC細胞質量及細胞安全性等問題均有待進一步探討和研究。