引用本文: 連海燕, 陳曉, 丁琴, 閆明, 黃珍, 晏穎, 宋艷萍. 傳統激光光凝與閾值下微脈沖激光光凝對增生型糖尿病視網膜病變玻璃體液中血管內皮生長因子、白細胞介素-33及一氧化氮濃度的影響. 中華眼底病雜志, 2019, 35(2): 124-128. doi: 10.3760/cma.j.issn.1005-1015.2019.02.004 復制
視網膜激光光凝是治療糖尿病視網膜病變(DR)的有效手段;既往研究結果顯示,其可降低50%中度非增生型DR(PDR)和有臨床意義黃斑水腫(DME)患眼的中度視力喪失[1]。閾值下微脈沖激光光凝可減輕DME[2-3]。但其具體控制、降低病變程度的機制尚不清楚。VEGF、IL-33及一氧化氮(NO)在增加血管通透性、促進血管生成中起到重要作用[4-6]。但目前對于兩種激光作用于人視網膜后早期對炎性蛋白影響的研究不多。因此,我們對一組PDR患眼分別行傳統激光光凝與閾值下微脈沖激光光凝,觀察兩種激光治療方式對PDR患眼玻璃體腔VEGF、IL-33、NO濃度的影響。現將結果報道如下。
1 對象和方法
病例對照研究。本研究遵循赫爾辛基宣言;患者均知情同意并簽署相應文件。
2015年11月在中部戰區總醫院眼科確診并行玻璃體切割手術(PPV)治療的PDR患者39例39只眼和特發性黃斑皺褶(IMP)患者11例11只眼納入研究。PDR患者39例中,男性29例,女性10例;均為單眼。平均年齡(57.12±9.63)歲。糖尿病病程自首次確診開始計算,其病程為2~20年,平均糖尿病病程(9.02±5.19)年。IMP患者11例中,男性7例,女性4例;均為單眼。平均年齡(53.78±3.26)歲。記錄患者年齡、性別構成、體重指數(BMI)、糖尿病病程、糖化血紅蛋白(HbA1c)、全身疾病史。
PDR患者納入標準:(1)符合2型糖尿病診斷標準[7]和DR診斷標準[8];(2)玻璃體積血保守治療3個月無效;(3)黃斑部牽拉性視網膜脫離和同時存在牽拉裂孔性視網膜脫離(眼底可行激光光凝治療);(4)需要行PPV治療。參照文獻[9]標準確立IMP患者納入標準。排除標準:曾行內眼手術或合并其他視網膜血管性病變如視網膜靜脈阻塞、視網膜靜脈周圍炎等;3個月內曾行激光光凝、抗炎、抗VEGF藥物等眼內治療;局部或全身患有可導致體內微環境變化的慢性炎癥性疾病。所有患眼均行視力、眼壓、裂隙燈顯微鏡聯合前置鏡、直接檢眼鏡、眼底彩色照相及FFA檢查。
依據就診順序按照隨機排列表方法將PDR患者分為氪激光治療組(A組)、閾值下微脈沖激光治療組(B組)、未行任何激光治療組(C組),分別為15、13、11只眼。IMP患者作為對照組(D組)。A組15只眼中,玻璃體積血10只眼,黃斑部牽拉性視網膜脫離3只眼,牽拉裂孔性視網膜脫離2只眼;B組13只眼,玻璃體積血7只眼,黃斑部牽拉性視網膜脫離3只眼,牽拉裂孔性視網膜脫離3只眼;C組11只眼中,玻璃體積血8只眼,黃斑部牽拉性視網膜脫離1只眼,牽拉裂孔性視網膜脫離2只眼。4組患者年齡(F=0.53,P=0.23)、性別構成(χ2=0.55,P=0.91)、BMI(F=2.64,P=0.07)、糖尿病病程(F=0.29,P=0.75)、HbA1c(F=1.72,P=0.19)比較,差異均無統計學意義(表1);A、B、C組玻璃體積血、黃斑部牽拉性視網膜脫離、牽拉裂孔性視網膜脫離眼數的構成比比較,差異無統計學意義(χ2=1.43,P=0.84)。
A、B組患眼分別行氪激光、閾值下微脈沖激光光凝治療。A組采用波532 nm氪離子激光機,激光參數:光斑直徑200 μm,功率250~380 mW,曝光時間0.15 s,Ⅱ級反應光斑,光斑間距約1個光斑直徑。根據FFA結果對周邊視網膜有較大范圍毛細血管無灌注區行500點光凝。B組采用半導體近810 nm紅外激光,調整機器設置為傳統連續波激光及單點模式,激光參數:光斑直徑200 μm,曝光時間0.15 s,在后極部血管弓外的視網膜上進行閾能量P測定。閾能量為剛能隱約看到視網膜變白時的激光能量[10]。然后轉換成微脈沖模式,采用5%負載系數,同樣根據FFA結果對周邊部視網膜較大范圍毛細血管無灌注區域行500點光凝治療。
激光光凝治療后3 d,所有患眼均行經睫狀體平坦部25G PPV;手術由同一醫生完成。打開灌注前,應用玻璃體切割頭抽取玻璃體液0.6 ml,置于微量離心管中,4 ℃下,1630×g離心10 min,取上清液?80 ℃凍存。手術后根據病情需要繼續行氪激光光凝治療。
二喹啉甲酸法檢測玻璃體液中總蛋白濃度;ELISA檢測玻璃體液中VEGF、IL-33、NO濃度。采用雙抗體夾心ELISA法,按照人總蛋白、人VEGF ELISA、人IL-33 ELISA、人NO ELISA試劑盒說明書進行操作。酶標儀450 nm波長讀取VEGF、IL-33、NO各孔的吸光度[A,舊稱光密度(OD)]值。以標準物濃度為縱坐標,A值為橫坐標,繪制標準曲線,計算總蛋白及VEGF、IL-33、NO實際濃度,復測2次取平均值。
采用SPSS19.0軟件進行統計學分析。計量資料以均數±標準差( )表示。多樣本均數比較采用單因素方差分析。P<0.05為差異有統計學意義。
)表示。多樣本均數比較采用單因素方差分析。P<0.05為差異有統計學意義。
2 結果
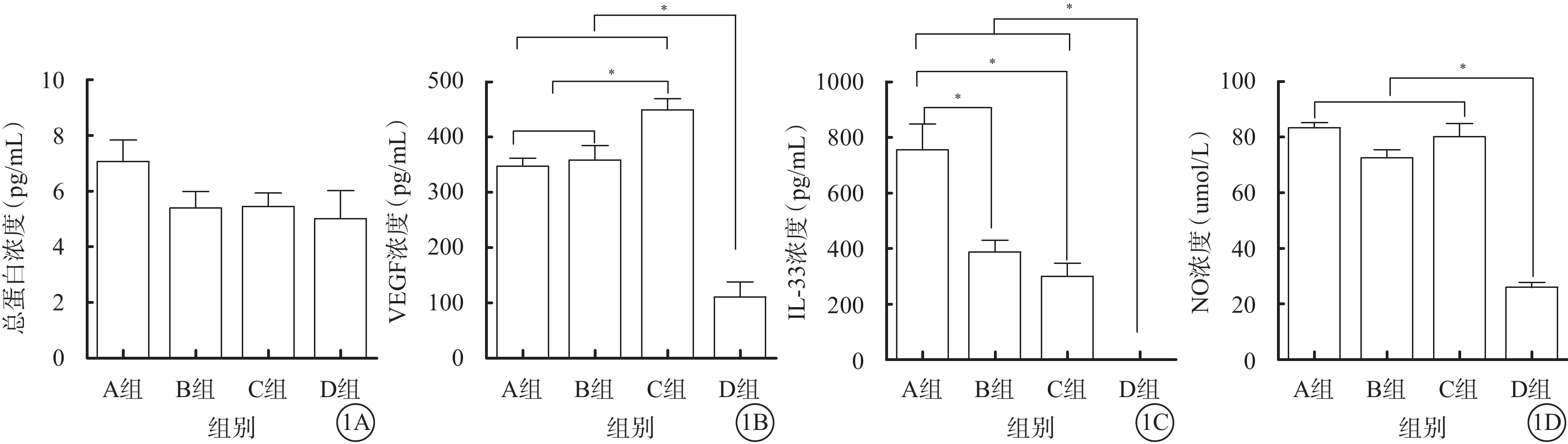
A、B、C、D組玻璃體液中總蛋白濃度分別為(7.06±2.56)、(5.39±1.98)、(5.44±1.52)、(5.01±2.23)pg/ml;4組間總蛋白濃度比較,差異無統計學意義(F=1.78,P=0.17)(圖1A)。
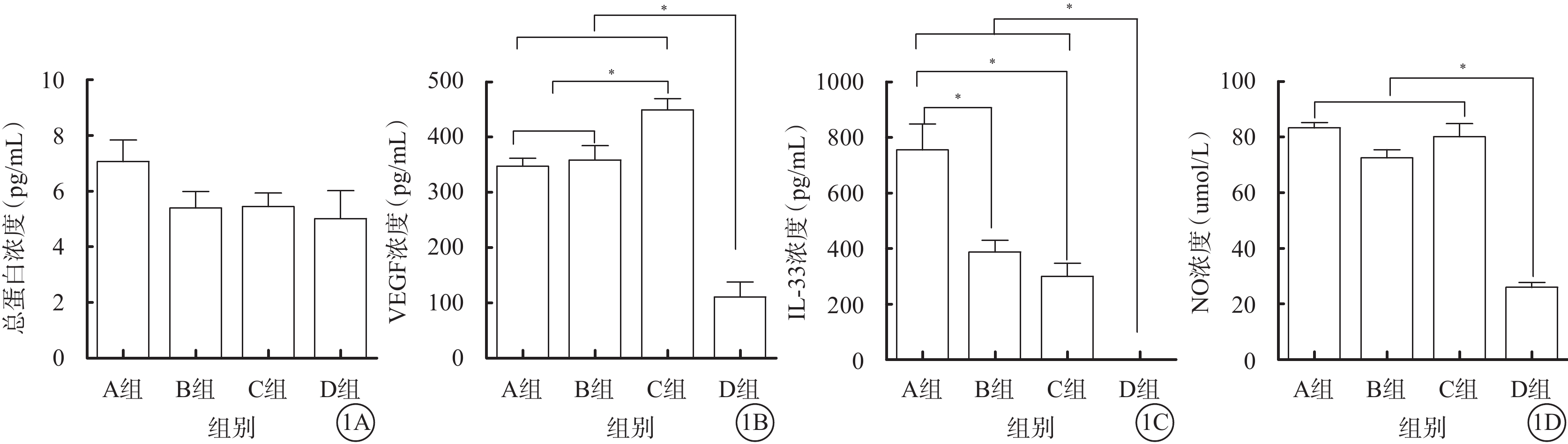 圖1
A、B、C、D組患眼玻璃體液中總蛋白、VEGF、IL-33、NO濃度比較。1A~1D分別示總蛋白、VEGF、IL-33、NO濃度。*P<0.05
圖1
A、B、C、D組患眼玻璃體液中總蛋白、VEGF、IL-33、NO濃度比較。1A~1D分別示總蛋白、VEGF、IL-33、NO濃度。*P<0.05
A、B、C、D組玻璃體液中VEGF濃度分別為(347.39±48.60)、(358.70±80.81)、(449.50±65.97)、(110.64±54.42)pg/ml。與D組VEGF濃度比較,A、B、C組均顯著升高,差異有統計學意義(F=26.73,P<0.001)。與C組VEGF濃度比較,A、B組均降低,差異有統計學意義(F=7.84,P=0.00);A、B組之間VEGF濃度比較,差異無統計學差異(t=?0.39,P=0.67)(圖1B)。
A、B、C、D組玻璃體液中IL-33濃度分別為(754.87±245.65)、(386.99±128.41)、(299.83±114.97)、(51.93±25.65)pg/ml。與D組IL-33濃度比較,A、B、C組均顯著升高,差異有統計學意義(F=21.10,P<0.001)。與C組IL-33濃度比較,A組差異有統計學意義(t=4.15,P=0.02);B組差異無統計學意義(t=1.34,P=0.20);A、B組之間差異有統計學意義(t=3.89,P=0.00)(圖1C)。
A、B、C、D組玻璃體液中NO濃度分別為(82.67±9.65)、(75.66±12.57)、(80.61±13.37)、(26.5±4.5)μmol/L。與D組比較,A、B、C組均顯著升高,差異有統計學意義(F=38.42,P<0.001)。A、B、C組間差異無統計學意義(F=3.29,P=0.06)(圖1D)。
3 討論
DR病程進展中,多種細胞因子、趨化因子及生長因子等參與調控炎癥反應與新生血管形成[11]。傳統氪激光以損傷線粒體豐富的組織和需氧量高的光感受器細胞為特點,可調控各種細胞因子的表達,如下調VEGF、成纖維細胞生長因子(FGF)-14,上調血管緊張素Ⅱ受體等[12-13]。閾值下微脈沖激光光凝主要選擇性作用于RPE而不引起可見的損傷[14],可引起小鼠RPE細胞VEGF-A、TGF-b和bFGF等蛋白減少[15]。本研究首次探討對比了傳統激光與閾值下微脈沖激光光凝對PDR患眼玻璃體液中炎性因子的影響,初步揭示激光光凝治療的機制。
本研究結果顯示,PDR患者玻璃體液中VEGF濃度高于非糖尿病患者,結果同既往文獻報道[16-17]。Manaviat等[18]、Mohamed和Mohamed[19]分別發現PDR患者行全視網膜激光光凝(PRP)2、3個月后其血清中VEGF濃度降低。我們分析其可能的原因為,上述兩項臨床研究的患者均行PRP,檢測樣本來源于血清,由于視網膜激光光凝對外周血液的影響較緩慢且較小,因此數月后VEGF濃度下降。而本研究中A、B組患眼光凝點數較少,直接檢測玻璃體液中VEGF濃度,因此3 d后VEGF濃度即下降,更直觀、準確揭示激光早起即可引起VEGF濃度下降。另外,兩項基礎研究發現,激光光凝可引起VEGF濃度數天內升高[20-21]。其原因可能是,傳統激光光凝作用于視網膜6 h后通過巨噬細胞聚集可上調VEGF表達,早期升高,而在7 d后VEGF濃度降低[20]。此外,激光光凝可破壞耗氧量光感受器和RPE細胞。在缺氧的情況下,低氧誘導因子-1(HIF-1)引起VEGF釋放[22]。光凝治療后可改善視網膜缺氧的狀態從而下調HIF-1,從而下調VEGF的表達。我們推測,激光光凝在早期產生炎性反應而引起VEGF上調,而隨光凝治療時間推移視網膜需氧量減少而VEGF表達降低。而在本研究中,我們推測500點激光點數產生的炎癥反應較輕,因此3 d后VEGF即下降。在今后的研究中進一步觀察激光光凝治療后不同時間點VEGF表達變化。
本研究結果顯示,B組患眼閾值下微脈沖激光光凝治療后3 d玻璃體液中VEGF濃度下降。Li等[15]也發現閾值下微脈沖激光可降低大鼠RPE細胞VEGF-A的表達。其原因是由于閾值下微脈沖激光光凝對RPE細胞具有生物調制效應[23]。此外,閾值下微脈沖激光光凝后,光凝周圍RPE細胞進行遷移增生,修復損傷RPE部位[24]。既往研究證實,低能量光凝引起損傷修復過程中TGF-1β的釋放[25-26]。TGF-1β可通過VEGF/Flk-1信號通路下調VEGF的表達[27]。因此我們推測,閾值下微脈沖激光同樣可通過作用于再生的RPE細胞而下調VEGF表達。IL-33是IL-1炎性家族中的一員[28],主要通過ST2信號通路發揮作用,能夠增加血管通透性并促進新生血管形成[29]。Takeuchi等[30]發現20%的PDR患者玻璃體液中可檢測到IL-33。本研究結果發現,PDR患者玻璃體液中IL-33顯著高于IMP患者。推測其可能在DR慢性炎癥過程中發揮重要作用。
本研究結果顯示,傳統激光光凝后PDR患者玻璃體液中IL-33濃度升高。Shimura等[31]也發現傳統激光光凝治療后玻璃體液中IL-6增加。既往研究證實,傳統激光光凝可引起炎性細胞遷移聚集[20, 32]。我們分析傳統激光光凝引起IL-33升高主要原因為:(1)傳統激光光凝治療后引起急性視網膜熱損傷,對細胞損傷較重。部分學者認為,IL-33主要由凋亡細胞分泌,因而引起炎性蛋白IL-33升高。(2)傳統激光光凝可引起Müller細胞遷移增生[33],光凝后Müller細胞在應激條件下可釋放IL-33。
然而,閾值下微脈沖激光光凝對PDR患者玻璃體液中IL-33無明顯影響。相比于傳統激光光凝,短脈沖激光光凝引起鼠視網膜更少的炎性細胞蛋白釋放[33-34]。本研究結果發現閾值下微脈沖激光光凝引起的IL-33變化更少。我們分析其可能的原因主要為:(1)閾值下微脈沖激光光凝主要作用于RPE細胞,引起視網膜損傷小,因此產生的炎性反應及細胞反應都小于傳統激光光凝;(2)閾值下微脈沖激光光凝可引起熱休克蛋白-70(HSP-70)上調[35],而HSP-70有抗炎作用[36]。相比于氪激光,閾值下微脈沖激光光凝在降低VEGF的同時引起的IL-33變化更少,這可成為閾值下微脈沖激光光凝治療的優勢。
內皮細胞產生的NO可促進新生血管形成并在血管重建與血管緊密連接中起重要作用,可被多種炎性蛋白如VEGF、血管緊張素-1所調控[37]。DR視網膜脫離患者玻璃體液、房水中NO濃度增加[38-39]。本研究結果也發現PDR患者玻璃體液中NO濃度高于IMH患者。既往研究顯示,PDR患者行PRP后3個月血清中NO濃度降低[19];視網膜激光光凝后24、72 h內玻璃體液中NO濃度升高[40]。本研究結果顯示,氪激光光凝與微脈沖激光光凝后3 d,光凝對PDR患眼玻璃體液中NO濃度無明顯影響。其可能原因為激光光凝產生的急性炎性環境和各種細胞因子在不同的時間點使NO濃度達到不同的動態平衡,如一方面IL-33通過ST2/TRAF6介導胞磷脂酰肌醇3激酶/絲氨酸-蘇氨酸蛋白激酶/一氧化氮合酶信號通路刺激內皮細胞表達NO[6];另一方面VEGF可通過CaM-Akt通路迅速合成NO,而激光光凝降低VEGF會減少NO的合成。
本研究樣本量偏小,探討激光光凝短時間內對玻璃體組織蛋白的影響,需進一步擴大樣本量、選擇更多炎性蛋白、設立多個時間點進一步全面研究。
視網膜激光光凝是治療糖尿病視網膜病變(DR)的有效手段;既往研究結果顯示,其可降低50%中度非增生型DR(PDR)和有臨床意義黃斑水腫(DME)患眼的中度視力喪失[1]。閾值下微脈沖激光光凝可減輕DME[2-3]。但其具體控制、降低病變程度的機制尚不清楚。VEGF、IL-33及一氧化氮(NO)在增加血管通透性、促進血管生成中起到重要作用[4-6]。但目前對于兩種激光作用于人視網膜后早期對炎性蛋白影響的研究不多。因此,我們對一組PDR患眼分別行傳統激光光凝與閾值下微脈沖激光光凝,觀察兩種激光治療方式對PDR患眼玻璃體腔VEGF、IL-33、NO濃度的影響。現將結果報道如下。
1 對象和方法
病例對照研究。本研究遵循赫爾辛基宣言;患者均知情同意并簽署相應文件。
2015年11月在中部戰區總醫院眼科確診并行玻璃體切割手術(PPV)治療的PDR患者39例39只眼和特發性黃斑皺褶(IMP)患者11例11只眼納入研究。PDR患者39例中,男性29例,女性10例;均為單眼。平均年齡(57.12±9.63)歲。糖尿病病程自首次確診開始計算,其病程為2~20年,平均糖尿病病程(9.02±5.19)年。IMP患者11例中,男性7例,女性4例;均為單眼。平均年齡(53.78±3.26)歲。記錄患者年齡、性別構成、體重指數(BMI)、糖尿病病程、糖化血紅蛋白(HbA1c)、全身疾病史。
PDR患者納入標準:(1)符合2型糖尿病診斷標準[7]和DR診斷標準[8];(2)玻璃體積血保守治療3個月無效;(3)黃斑部牽拉性視網膜脫離和同時存在牽拉裂孔性視網膜脫離(眼底可行激光光凝治療);(4)需要行PPV治療。參照文獻[9]標準確立IMP患者納入標準。排除標準:曾行內眼手術或合并其他視網膜血管性病變如視網膜靜脈阻塞、視網膜靜脈周圍炎等;3個月內曾行激光光凝、抗炎、抗VEGF藥物等眼內治療;局部或全身患有可導致體內微環境變化的慢性炎癥性疾病。所有患眼均行視力、眼壓、裂隙燈顯微鏡聯合前置鏡、直接檢眼鏡、眼底彩色照相及FFA檢查。
依據就診順序按照隨機排列表方法將PDR患者分為氪激光治療組(A組)、閾值下微脈沖激光治療組(B組)、未行任何激光治療組(C組),分別為15、13、11只眼。IMP患者作為對照組(D組)。A組15只眼中,玻璃體積血10只眼,黃斑部牽拉性視網膜脫離3只眼,牽拉裂孔性視網膜脫離2只眼;B組13只眼,玻璃體積血7只眼,黃斑部牽拉性視網膜脫離3只眼,牽拉裂孔性視網膜脫離3只眼;C組11只眼中,玻璃體積血8只眼,黃斑部牽拉性視網膜脫離1只眼,牽拉裂孔性視網膜脫離2只眼。4組患者年齡(F=0.53,P=0.23)、性別構成(χ2=0.55,P=0.91)、BMI(F=2.64,P=0.07)、糖尿病病程(F=0.29,P=0.75)、HbA1c(F=1.72,P=0.19)比較,差異均無統計學意義(表1);A、B、C組玻璃體積血、黃斑部牽拉性視網膜脫離、牽拉裂孔性視網膜脫離眼數的構成比比較,差異無統計學意義(χ2=1.43,P=0.84)。
A、B組患眼分別行氪激光、閾值下微脈沖激光光凝治療。A組采用波532 nm氪離子激光機,激光參數:光斑直徑200 μm,功率250~380 mW,曝光時間0.15 s,Ⅱ級反應光斑,光斑間距約1個光斑直徑。根據FFA結果對周邊視網膜有較大范圍毛細血管無灌注區行500點光凝。B組采用半導體近810 nm紅外激光,調整機器設置為傳統連續波激光及單點模式,激光參數:光斑直徑200 μm,曝光時間0.15 s,在后極部血管弓外的視網膜上進行閾能量P測定。閾能量為剛能隱約看到視網膜變白時的激光能量[10]。然后轉換成微脈沖模式,采用5%負載系數,同樣根據FFA結果對周邊部視網膜較大范圍毛細血管無灌注區域行500點光凝治療。
激光光凝治療后3 d,所有患眼均行經睫狀體平坦部25G PPV;手術由同一醫生完成。打開灌注前,應用玻璃體切割頭抽取玻璃體液0.6 ml,置于微量離心管中,4 ℃下,1630×g離心10 min,取上清液?80 ℃凍存。手術后根據病情需要繼續行氪激光光凝治療。
二喹啉甲酸法檢測玻璃體液中總蛋白濃度;ELISA檢測玻璃體液中VEGF、IL-33、NO濃度。采用雙抗體夾心ELISA法,按照人總蛋白、人VEGF ELISA、人IL-33 ELISA、人NO ELISA試劑盒說明書進行操作。酶標儀450 nm波長讀取VEGF、IL-33、NO各孔的吸光度[A,舊稱光密度(OD)]值。以標準物濃度為縱坐標,A值為橫坐標,繪制標準曲線,計算總蛋白及VEGF、IL-33、NO實際濃度,復測2次取平均值。
采用SPSS19.0軟件進行統計學分析。計量資料以均數±標準差( )表示。多樣本均數比較采用單因素方差分析。P<0.05為差異有統計學意義。
)表示。多樣本均數比較采用單因素方差分析。P<0.05為差異有統計學意義。
2 結果
A、B、C、D組玻璃體液中總蛋白濃度分別為(7.06±2.56)、(5.39±1.98)、(5.44±1.52)、(5.01±2.23)pg/ml;4組間總蛋白濃度比較,差異無統計學意義(F=1.78,P=0.17)(圖1A)。
 圖1
A、B、C、D組患眼玻璃體液中總蛋白、VEGF、IL-33、NO濃度比較。1A~1D分別示總蛋白、VEGF、IL-33、NO濃度。*P<0.05
圖1
A、B、C、D組患眼玻璃體液中總蛋白、VEGF、IL-33、NO濃度比較。1A~1D分別示總蛋白、VEGF、IL-33、NO濃度。*P<0.05
A、B、C、D組玻璃體液中VEGF濃度分別為(347.39±48.60)、(358.70±80.81)、(449.50±65.97)、(110.64±54.42)pg/ml。與D組VEGF濃度比較,A、B、C組均顯著升高,差異有統計學意義(F=26.73,P<0.001)。與C組VEGF濃度比較,A、B組均降低,差異有統計學意義(F=7.84,P=0.00);A、B組之間VEGF濃度比較,差異無統計學差異(t=?0.39,P=0.67)(圖1B)。
A、B、C、D組玻璃體液中IL-33濃度分別為(754.87±245.65)、(386.99±128.41)、(299.83±114.97)、(51.93±25.65)pg/ml。與D組IL-33濃度比較,A、B、C組均顯著升高,差異有統計學意義(F=21.10,P<0.001)。與C組IL-33濃度比較,A組差異有統計學意義(t=4.15,P=0.02);B組差異無統計學意義(t=1.34,P=0.20);A、B組之間差異有統計學意義(t=3.89,P=0.00)(圖1C)。
A、B、C、D組玻璃體液中NO濃度分別為(82.67±9.65)、(75.66±12.57)、(80.61±13.37)、(26.5±4.5)μmol/L。與D組比較,A、B、C組均顯著升高,差異有統計學意義(F=38.42,P<0.001)。A、B、C組間差異無統計學意義(F=3.29,P=0.06)(圖1D)。
3 討論
DR病程進展中,多種細胞因子、趨化因子及生長因子等參與調控炎癥反應與新生血管形成[11]。傳統氪激光以損傷線粒體豐富的組織和需氧量高的光感受器細胞為特點,可調控各種細胞因子的表達,如下調VEGF、成纖維細胞生長因子(FGF)-14,上調血管緊張素Ⅱ受體等[12-13]。閾值下微脈沖激光光凝主要選擇性作用于RPE而不引起可見的損傷[14],可引起小鼠RPE細胞VEGF-A、TGF-b和bFGF等蛋白減少[15]。本研究首次探討對比了傳統激光與閾值下微脈沖激光光凝對PDR患眼玻璃體液中炎性因子的影響,初步揭示激光光凝治療的機制。
本研究結果顯示,PDR患者玻璃體液中VEGF濃度高于非糖尿病患者,結果同既往文獻報道[16-17]。Manaviat等[18]、Mohamed和Mohamed[19]分別發現PDR患者行全視網膜激光光凝(PRP)2、3個月后其血清中VEGF濃度降低。我們分析其可能的原因為,上述兩項臨床研究的患者均行PRP,檢測樣本來源于血清,由于視網膜激光光凝對外周血液的影響較緩慢且較小,因此數月后VEGF濃度下降。而本研究中A、B組患眼光凝點數較少,直接檢測玻璃體液中VEGF濃度,因此3 d后VEGF濃度即下降,更直觀、準確揭示激光早起即可引起VEGF濃度下降。另外,兩項基礎研究發現,激光光凝可引起VEGF濃度數天內升高[20-21]。其原因可能是,傳統激光光凝作用于視網膜6 h后通過巨噬細胞聚集可上調VEGF表達,早期升高,而在7 d后VEGF濃度降低[20]。此外,激光光凝可破壞耗氧量光感受器和RPE細胞。在缺氧的情況下,低氧誘導因子-1(HIF-1)引起VEGF釋放[22]。光凝治療后可改善視網膜缺氧的狀態從而下調HIF-1,從而下調VEGF的表達。我們推測,激光光凝在早期產生炎性反應而引起VEGF上調,而隨光凝治療時間推移視網膜需氧量減少而VEGF表達降低。而在本研究中,我們推測500點激光點數產生的炎癥反應較輕,因此3 d后VEGF即下降。在今后的研究中進一步觀察激光光凝治療后不同時間點VEGF表達變化。
本研究結果顯示,B組患眼閾值下微脈沖激光光凝治療后3 d玻璃體液中VEGF濃度下降。Li等[15]也發現閾值下微脈沖激光可降低大鼠RPE細胞VEGF-A的表達。其原因是由于閾值下微脈沖激光光凝對RPE細胞具有生物調制效應[23]。此外,閾值下微脈沖激光光凝后,光凝周圍RPE細胞進行遷移增生,修復損傷RPE部位[24]。既往研究證實,低能量光凝引起損傷修復過程中TGF-1β的釋放[25-26]。TGF-1β可通過VEGF/Flk-1信號通路下調VEGF的表達[27]。因此我們推測,閾值下微脈沖激光同樣可通過作用于再生的RPE細胞而下調VEGF表達。IL-33是IL-1炎性家族中的一員[28],主要通過ST2信號通路發揮作用,能夠增加血管通透性并促進新生血管形成[29]。Takeuchi等[30]發現20%的PDR患者玻璃體液中可檢測到IL-33。本研究結果發現,PDR患者玻璃體液中IL-33顯著高于IMP患者。推測其可能在DR慢性炎癥過程中發揮重要作用。
本研究結果顯示,傳統激光光凝后PDR患者玻璃體液中IL-33濃度升高。Shimura等[31]也發現傳統激光光凝治療后玻璃體液中IL-6增加。既往研究證實,傳統激光光凝可引起炎性細胞遷移聚集[20, 32]。我們分析傳統激光光凝引起IL-33升高主要原因為:(1)傳統激光光凝治療后引起急性視網膜熱損傷,對細胞損傷較重。部分學者認為,IL-33主要由凋亡細胞分泌,因而引起炎性蛋白IL-33升高。(2)傳統激光光凝可引起Müller細胞遷移增生[33],光凝后Müller細胞在應激條件下可釋放IL-33。
然而,閾值下微脈沖激光光凝對PDR患者玻璃體液中IL-33無明顯影響。相比于傳統激光光凝,短脈沖激光光凝引起鼠視網膜更少的炎性細胞蛋白釋放[33-34]。本研究結果發現閾值下微脈沖激光光凝引起的IL-33變化更少。我們分析其可能的原因主要為:(1)閾值下微脈沖激光光凝主要作用于RPE細胞,引起視網膜損傷小,因此產生的炎性反應及細胞反應都小于傳統激光光凝;(2)閾值下微脈沖激光光凝可引起熱休克蛋白-70(HSP-70)上調[35],而HSP-70有抗炎作用[36]。相比于氪激光,閾值下微脈沖激光光凝在降低VEGF的同時引起的IL-33變化更少,這可成為閾值下微脈沖激光光凝治療的優勢。
內皮細胞產生的NO可促進新生血管形成并在血管重建與血管緊密連接中起重要作用,可被多種炎性蛋白如VEGF、血管緊張素-1所調控[37]。DR視網膜脫離患者玻璃體液、房水中NO濃度增加[38-39]。本研究結果也發現PDR患者玻璃體液中NO濃度高于IMH患者。既往研究顯示,PDR患者行PRP后3個月血清中NO濃度降低[19];視網膜激光光凝后24、72 h內玻璃體液中NO濃度升高[40]。本研究結果顯示,氪激光光凝與微脈沖激光光凝后3 d,光凝對PDR患眼玻璃體液中NO濃度無明顯影響。其可能原因為激光光凝產生的急性炎性環境和各種細胞因子在不同的時間點使NO濃度達到不同的動態平衡,如一方面IL-33通過ST2/TRAF6介導胞磷脂酰肌醇3激酶/絲氨酸-蘇氨酸蛋白激酶/一氧化氮合酶信號通路刺激內皮細胞表達NO[6];另一方面VEGF可通過CaM-Akt通路迅速合成NO,而激光光凝降低VEGF會減少NO的合成。
本研究樣本量偏小,探討激光光凝短時間內對玻璃體組織蛋白的影響,需進一步擴大樣本量、選擇更多炎性蛋白、設立多個時間點進一步全面研究。