引用本文: 劉勃實, 東莉潔, 李筱榮, 張琰, 張明亮, 劉勛, 黃亮瑜, 吳綿綿, 徐嫚鴻, 蘇睿虹, 張哲, 韓金棟. 慢病毒介導的微小RNA-191對小鼠視網膜新生血管的抑制作用. 中華眼底病雜志, 2019, 35(5): 475-479. doi: 10.3760/cma.j.issn.1005-1015.2019.05.010 復制
視網膜新生血管(RNV)疾病是導致視覺障礙的主要原因。異常增生的新生血管通過多種途徑受到多種因子的調節[1-2]。微小RNA(miR)作為一種大小約22個堿基的單鏈非編碼小分子RNA,參與基因轉錄后的表達調控,其廣泛存在于多細胞生物中,幾乎參與所有生物學過程[3-6]。miR-191作為miRNA的一種,通過調控細胞增生、分化、凋亡以及遷移,參與多種疾病的發生、發展[7],并且可以通過激活多種途徑抑制新生血管生成[8]。為進一步明確miR-191對RNV的抑制作用及機制,我們將慢病毒介導的miR-191轉染至小鼠視網膜,觀察RNV的生成情況,同時檢測視網膜組織中miR-191、p21的表達情況。現將結果報道如下。
1 材料和方法
攜帶miR-191(LV-191)、綠色熒光蛋白(LV-GFP)慢病毒載體由上海漢恒生物科技有限公司提供。逆轉錄試劑盒AE301由北京全式金生生物技術有限公司提供。
健康C57BL/6J小鼠80只,7日齡,平均體重(3.52±0.35)g,雌雄不限,清潔級;由斯貝福公司提供。飼養環境及實驗操作均符合國家科學技術委員會《實驗動物管理條例》的規定,并獲得天津醫科大學眼科醫院動物倫理委員會許可(動物倫理批號TJYY20190103002)。采用隨機數字表法將小鼠隨機分為正常組、非干預組、LV-191組、生理鹽水(NS)組、LV-GFP組,每組16只。參照文獻[9]的方法構建氧誘導RNV(OIR)小鼠模型。非干預組、LV-191組、NS組、LV-GFP組小鼠置于含氧體積分數為(75±2)%的飼養箱中,平均溫度維持在(23±2)℃,氧氣分析儀監測并調控飼養箱內的氧氣含量,5次/d;高氧環境下連續飼養5 d后,置于正常空氣環境中。正常組小鼠于正常空氣中飼養5 d,不做任何處理。小鼠12日齡時,LV-191組、NS組、LV-GFP組小鼠右眼玻璃體腔分別注射1 μl LV-191、NS、LV-GFP;非干預組小鼠不做玻璃體腔注射,置于正常空氣中飼養。
小鼠17日齡時,每組隨機選取4只小鼠腹腔注射10%水合氯醛處死。摘除眼球于4%多聚甲醛中室溫固定1 h,PBS中4 ℃保存。手術顯微鏡下剝離完整視網膜,4 ℃過夜固定。參照文獻[10]的方法對視網膜血管進行染色。染色后的標本以節細胞層向上平鋪于載玻片上,含DAPI的抗熒光衰退封片劑封片,熒光顯微鏡下用相同的光學參數拍照。手動測量無灌注區面積,并用該面積所占全視網膜面積的百分比表示。
小鼠17日齡時,每組隨機選取4只小鼠,處死方法同前。摘除眼球,標記方向后置于4%多聚甲醛中4 °C過夜。常規脫水、透明、浸蠟,石蠟包埋,矢狀面平行視神經連續切片,片厚5 μm,相鄰2張切片間隔30 μm,去掉含有視神經的切面。每只眼球選取10張切片,常規脫蠟后HE染色。雙盲法統計每張切片中突破視網膜內界膜的血管內皮細胞核數目,同時排除玻璃體腔與視網膜內界膜無聯系的血管內皮細胞核。
實時定量PCR(RT-PCR)檢測各組小鼠視網膜中p21、miR-191 mRNA相對表達量。小鼠17日齡時,每組選取8只小鼠,處死方法同前。摘除眼球,取出視網膜組織,Trizol一步法提取總RNA。按照逆轉錄試劑盒操作說明逆轉錄合成cDNA,以cDNA為模版進行PCR擴增,總反應體系200 μl。由北京擎科新業生物技術有限公司設計并合成p21及miR-191特異性引物。p21:正向引物:TGAAGCAGTCACAGCCTAGAA,反向引物:CAGGTCTGAGCAATGTCAAG,擴增片段長度80 堿基對;miR-191引物:CAACGGAATCCCAAAAGCAGC。PCR反應條件:95 °C預變性5 min,95 °C變性10 s,退火30 s,退火溫度60 °C,共40次循環。應用熔解曲線檢測產物特異性,60~97 °C緩慢增加溫度,每°C采集5次熒光,繪制成溶解曲線。目的基因擴增產物的相對含量應用2?ΔΔCT 2進行計算。
采用SPSS22.0軟件行統計學處理。所有數據以均數±標準差( )表示。組間比較采用單因素方差分析,兩兩比較采用Bonferroni事后檢驗。P<0.05為差異有統計學意義。
)表示。組間比較采用單因素方差分析,兩兩比較采用Bonferroni事后檢驗。P<0.05為差異有統計學意義。
2 結果
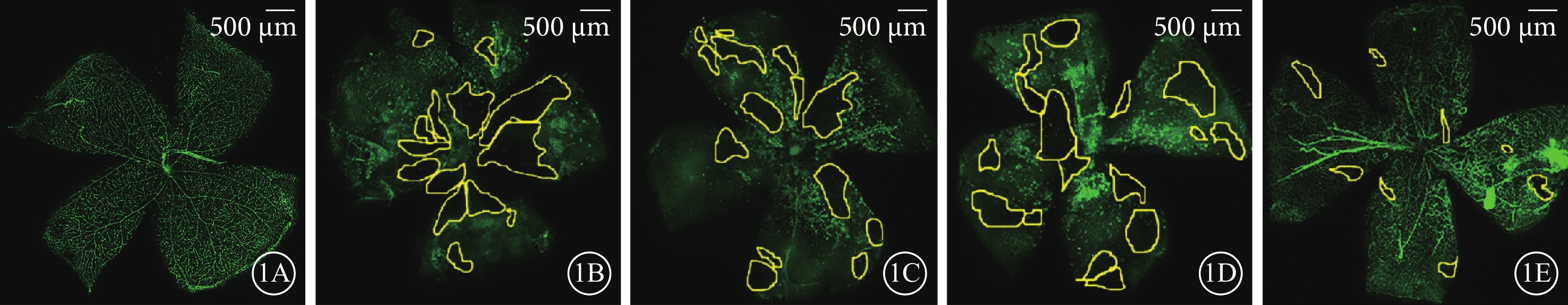
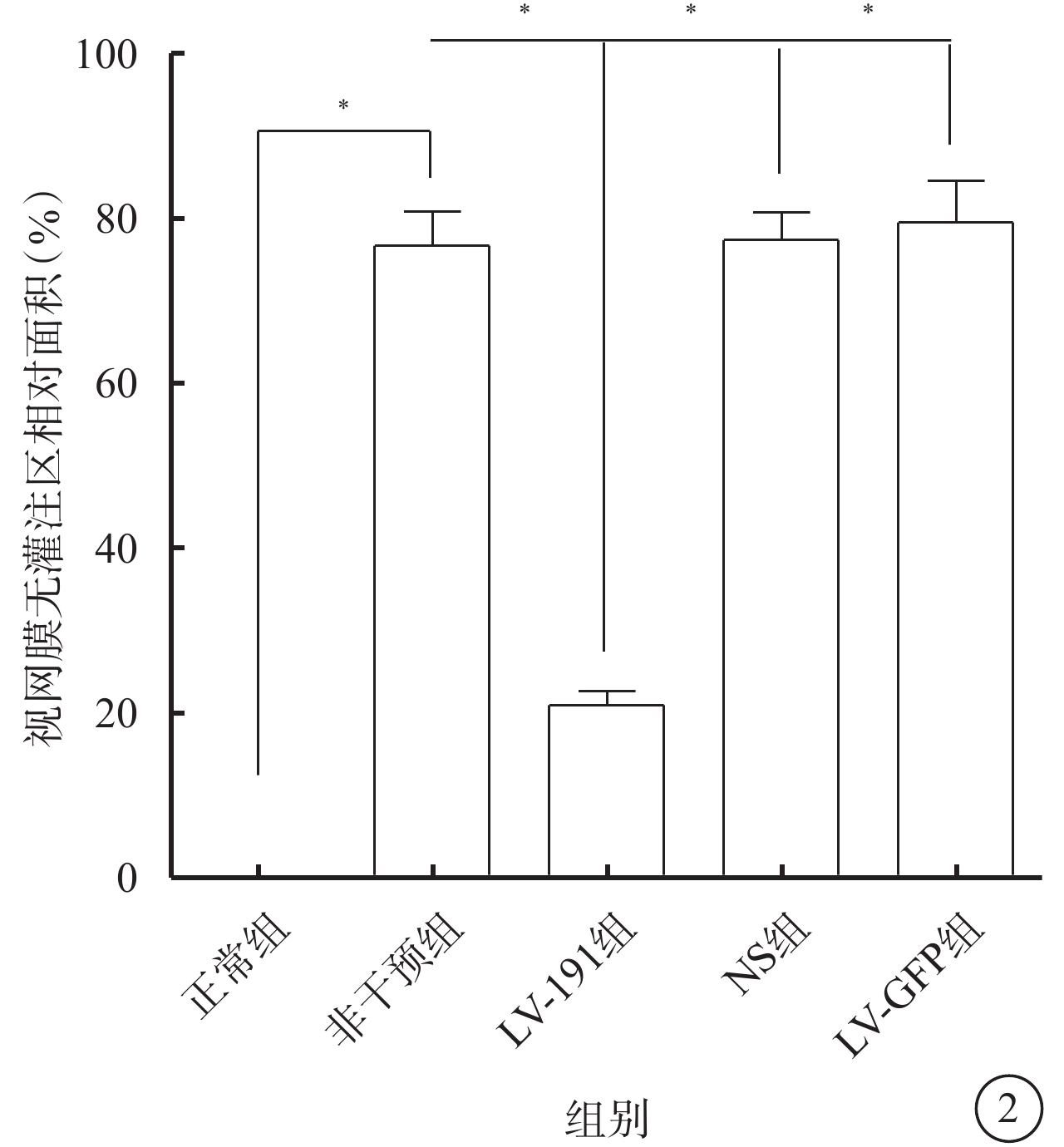
熒光顯微鏡觀察發現,正常組小鼠視網膜未見明顯無灌注區及RNV(圖1A);非干預組、NS組、LV-空白組小鼠視網膜均可見大量無灌注區和RNV(圖1B~1D);LV-191組小鼠視網膜可見少量無灌注區及RNV(圖1E)。正常組、非干預組、LV-191組、NS組、LV-空白組小鼠視網膜無灌注區面積比較,差異有統計學意義(F=127.20,P<0.001)(圖2)。非干預組小鼠視網膜無灌注區面積較正常組明顯增多,差異有統計學意義(P<0.001);LV-191組小鼠視網膜無灌注區面積分別較非干預組、NS組、LV-GFP組明顯減少,差異有統計學意義(P=0.000 2、0.000 1、0.000 4)
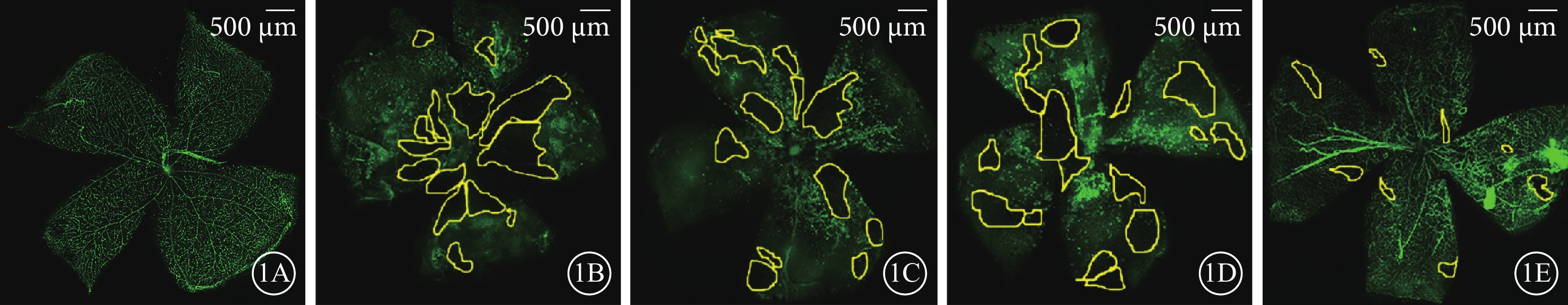 圖1
各組小鼠視網膜血管鋪片熒光顯微鏡像。1A示正常組,視網膜未見明顯無灌注區及RNV;1B~1D分別示非干預組、NS組、LV-GFP組,視網膜大量無灌注區(黃色實線區域)和RNV;1E示LV-191組,視網膜少量無灌注區(黃色實線區域)及RNV 標尺:500 μm
圖1
各組小鼠視網膜血管鋪片熒光顯微鏡像。1A示正常組,視網膜未見明顯無灌注區及RNV;1B~1D分別示非干預組、NS組、LV-GFP組,視網膜大量無灌注區(黃色實線區域)和RNV;1E示LV-191組,視網膜少量無灌注區(黃色實線區域)及RNV 標尺:500 μm
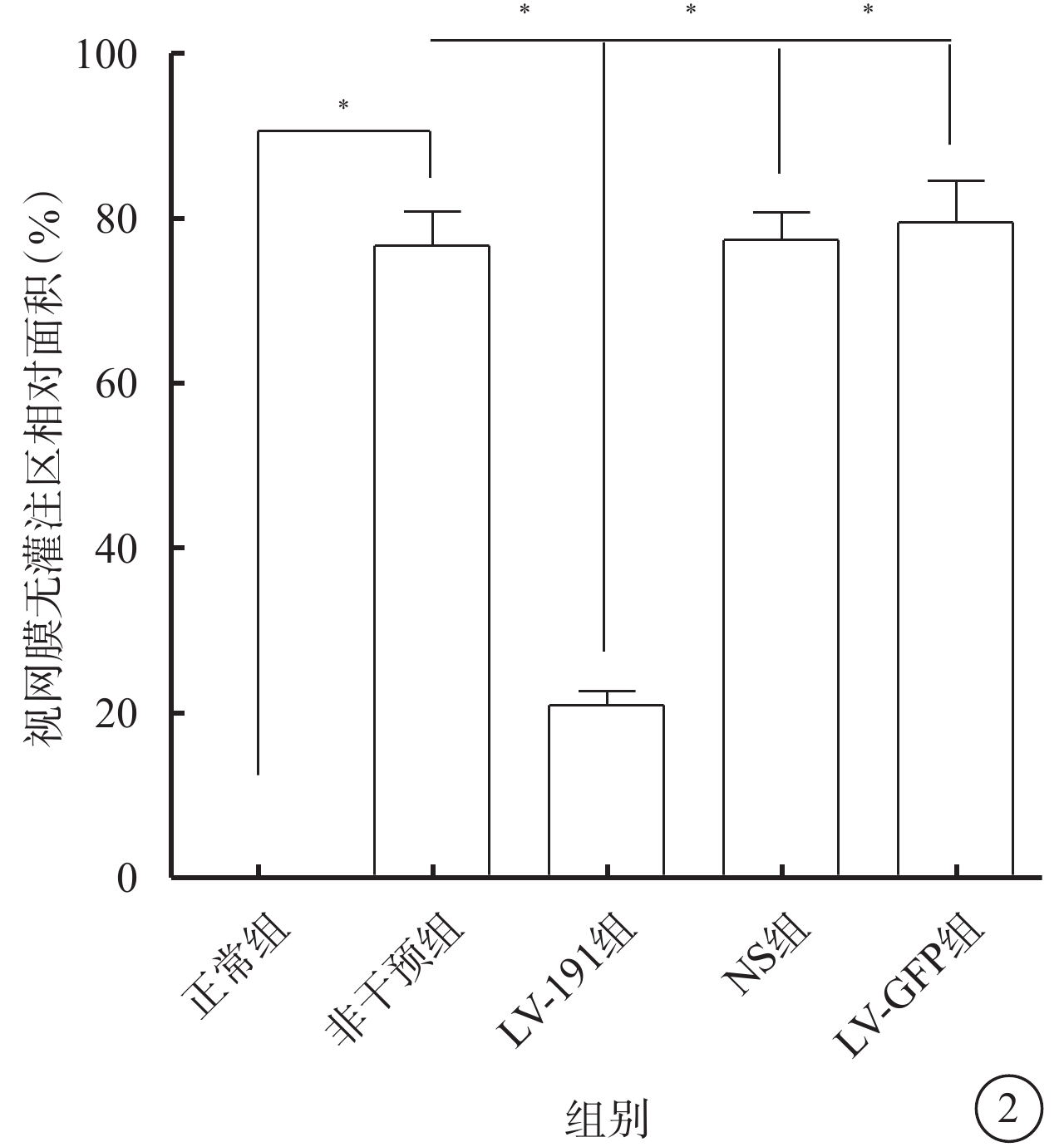 圖2
各組小鼠視網膜無灌注區相對面積定量比較。*P<0.05
圖2
各組小鼠視網膜無灌注區相對面積定量比較。*P<0.05
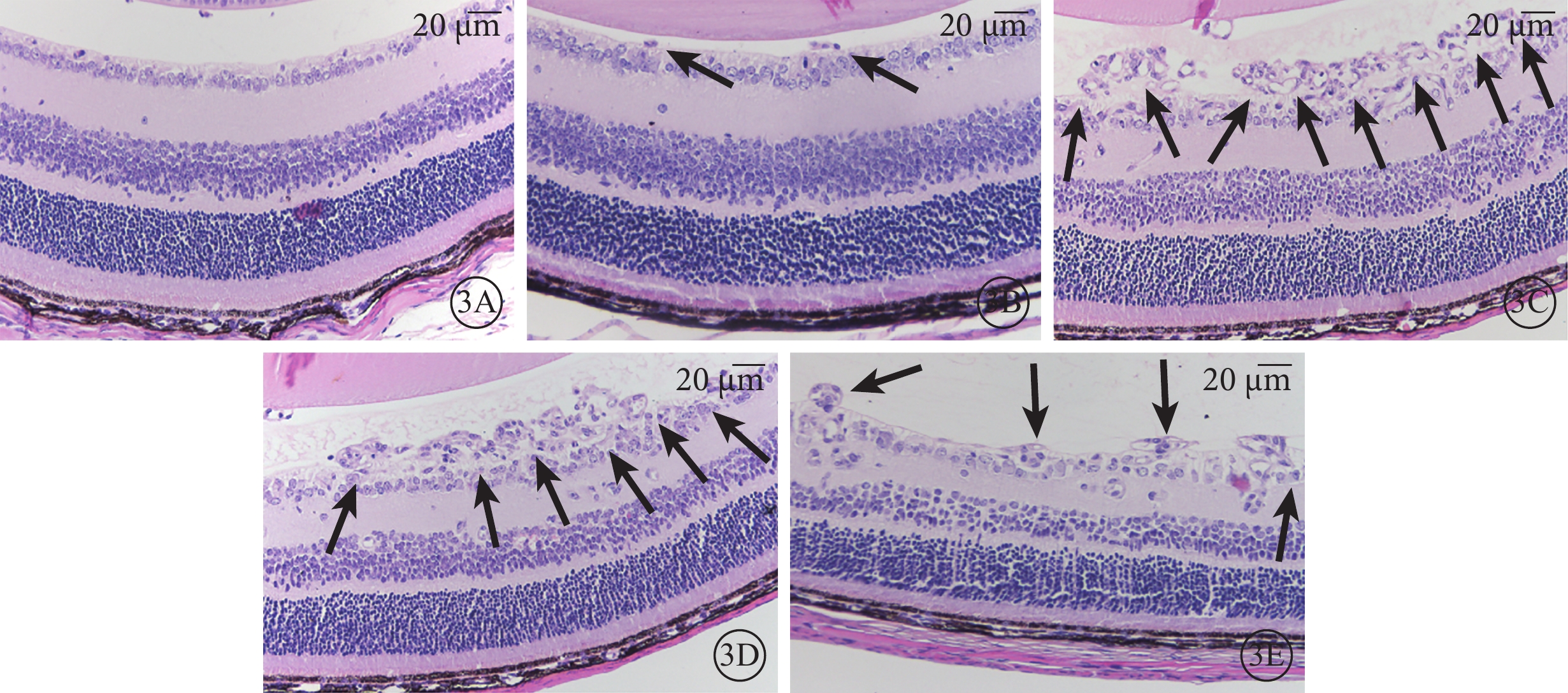
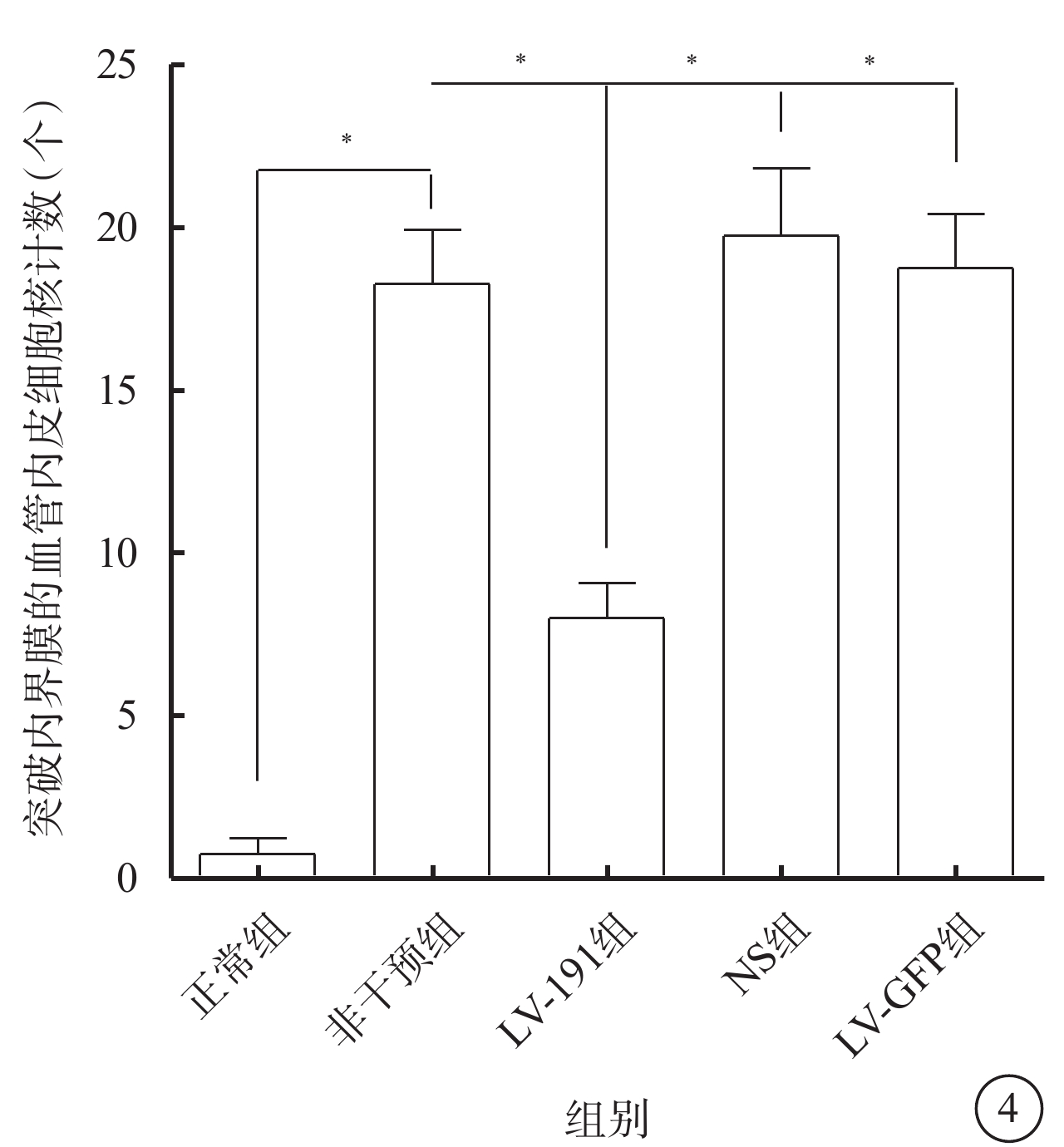
光學顯微鏡觀察發現,正常組小鼠未見突破內界膜的血管內皮細胞核(圖3A);LV-191組小鼠可見少量突破內界膜的血管內皮細胞核(圖3B);非干預組、NS組、LV-GFP組小鼠可見大量突破內界膜的血管內皮細胞核(圖3C~3E)。正常組、非干預組、LV-191組、NS組、LV-空白組小鼠突破內界膜的血管內皮細胞核計數比較,差異有統計學意義(F=31.71,P<0.05)(圖4)。非干預組小鼠突破內界膜的血管內皮細胞核計數較正常組明顯增多,差異有統計學意義(P<0.05);LV-191組小鼠突破內界膜的血管內皮細胞核計數較非干預組、NS組、LV-GFP組明顯減少,差異有統計學意義(P=0.002 0、0.002 3、0.001 6)。
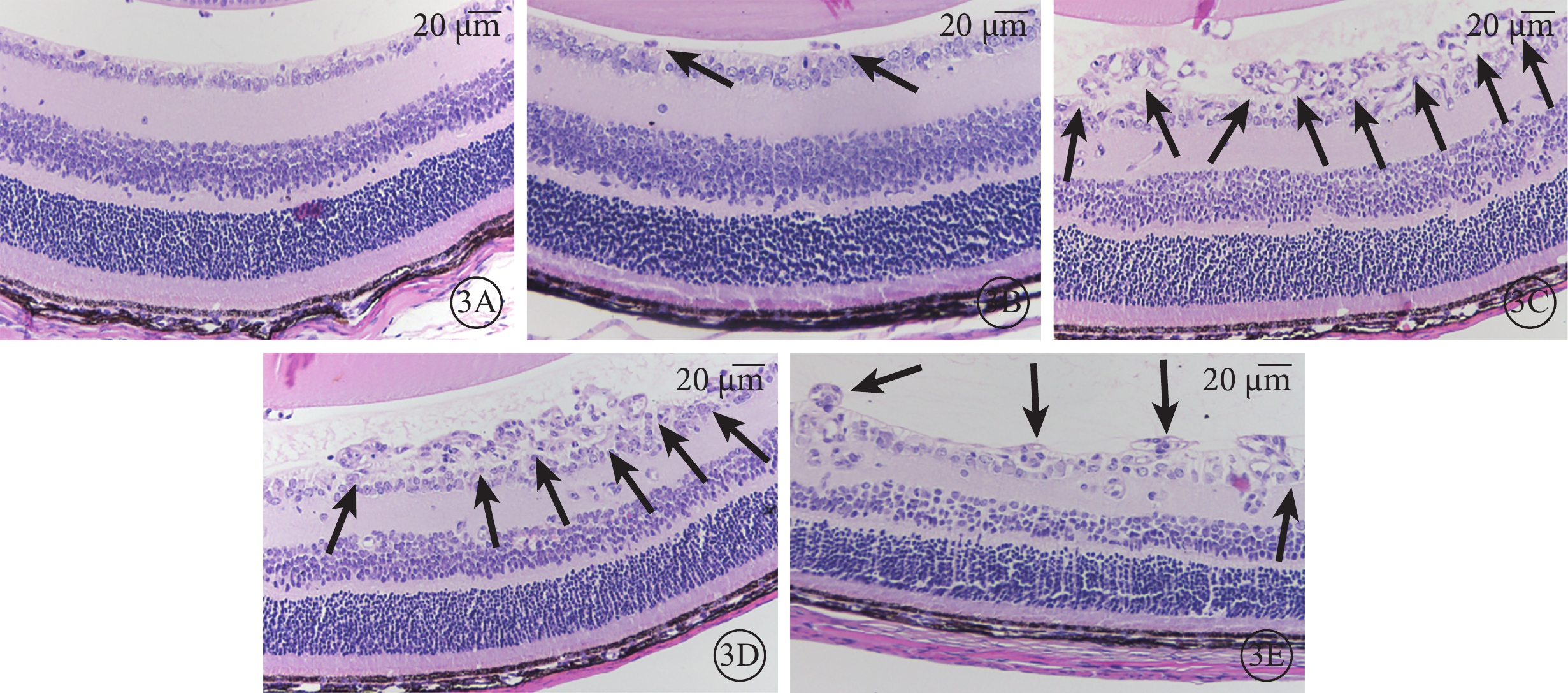 圖3
各組小鼠視網膜組織病理像。3A示正常組,未見突破內界膜的視網膜血管內皮細胞核;3B示LV-191組,可見少量突破內界膜的血管內皮細胞核(黑箭);3C~3E分別示非干預組、NS組、LV-GFP組,可見大量突破內界膜的血管內皮細胞核(黑箭) HE 標尺:20 μm
圖3
各組小鼠視網膜組織病理像。3A示正常組,未見突破內界膜的視網膜血管內皮細胞核;3B示LV-191組,可見少量突破內界膜的血管內皮細胞核(黑箭);3C~3E分別示非干預組、NS組、LV-GFP組,可見大量突破內界膜的血管內皮細胞核(黑箭) HE 標尺:20 μm
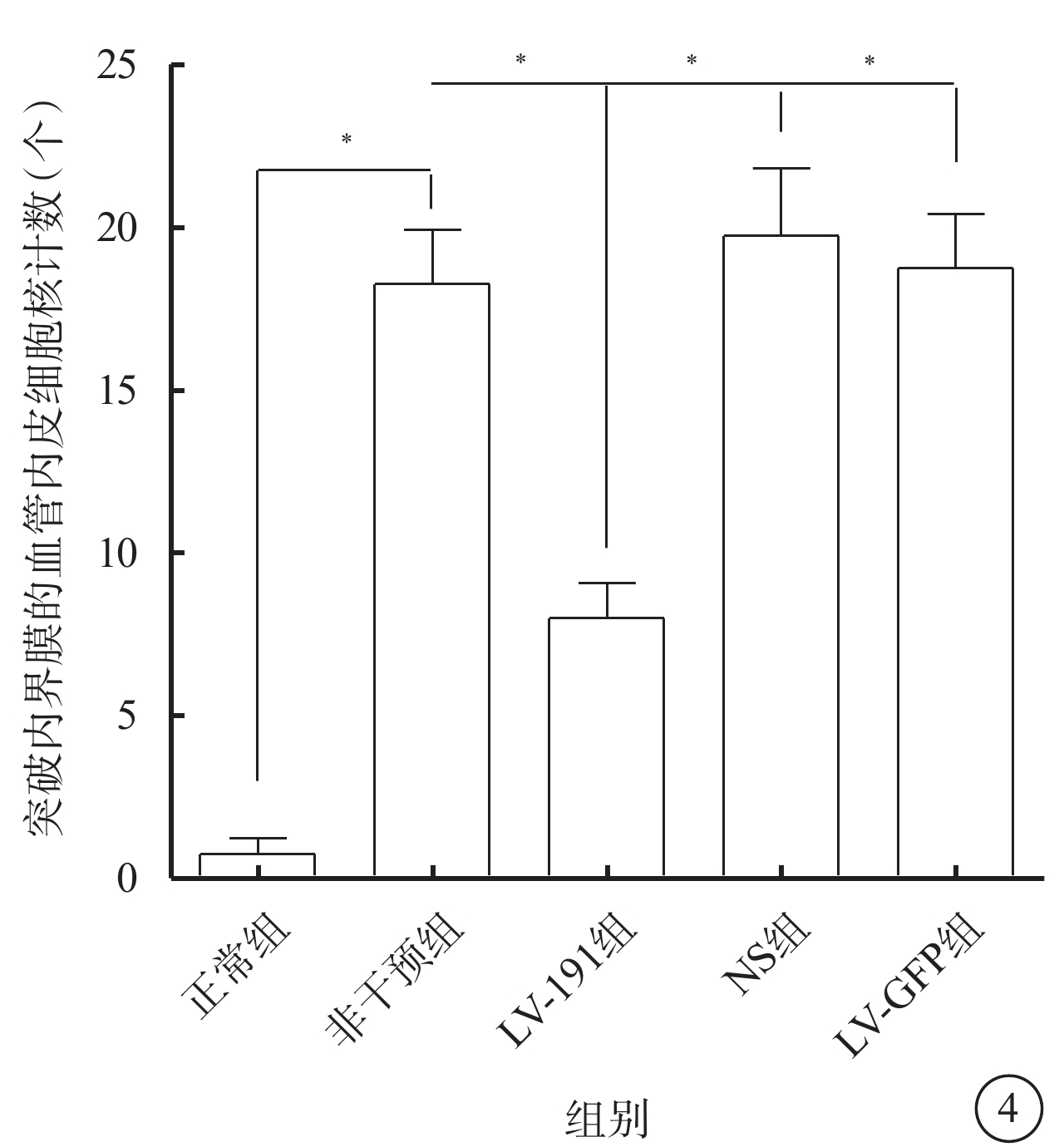 圖4
各組小鼠突破內界膜的血管內皮細胞核計數定量比較。*P<0.05
圖4
各組小鼠突破內界膜的血管內皮細胞核計數定量比較。*P<0.05
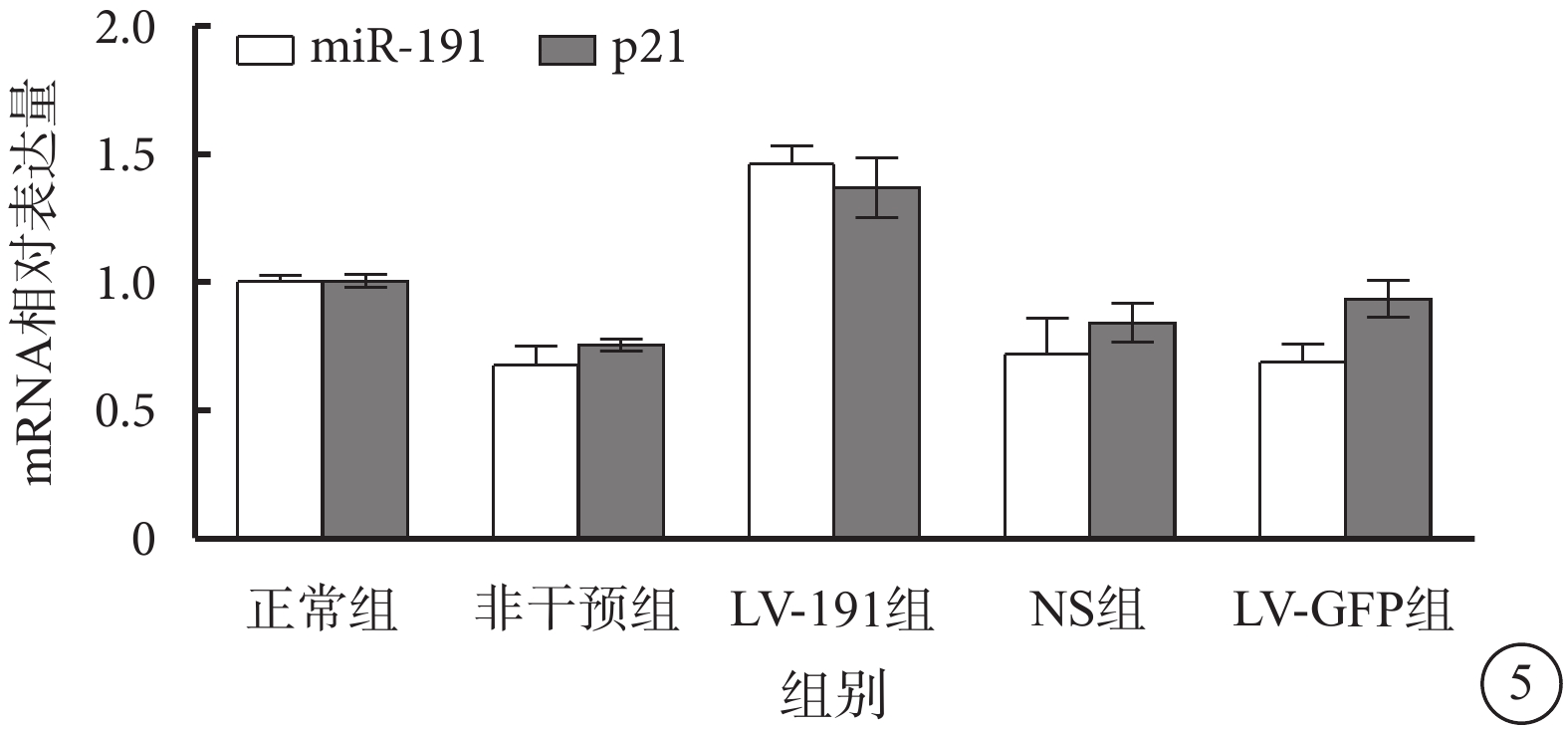
RT-PCR檢測發現,正常組、非干預組、LV-191組、NS組、LV-GFP組小鼠視網膜中miR-191、p21 mRNA相對表達量比較,差異有統計學意義(F=10.95、15.60,P<0.05、<0.05)(圖5)。與正常組小鼠視網膜中miR-191、p21 mRNA相對表達量比較,LV-191組相對表達量明顯上調,差異有統計學意義(P<0.05);與非干預組、NS組、LV-空白組小鼠視網膜miR-191、p21 mRNA相對表達量比較,LV-191組相對表達量明顯上調,差異有統計學意義(P<0.05)。
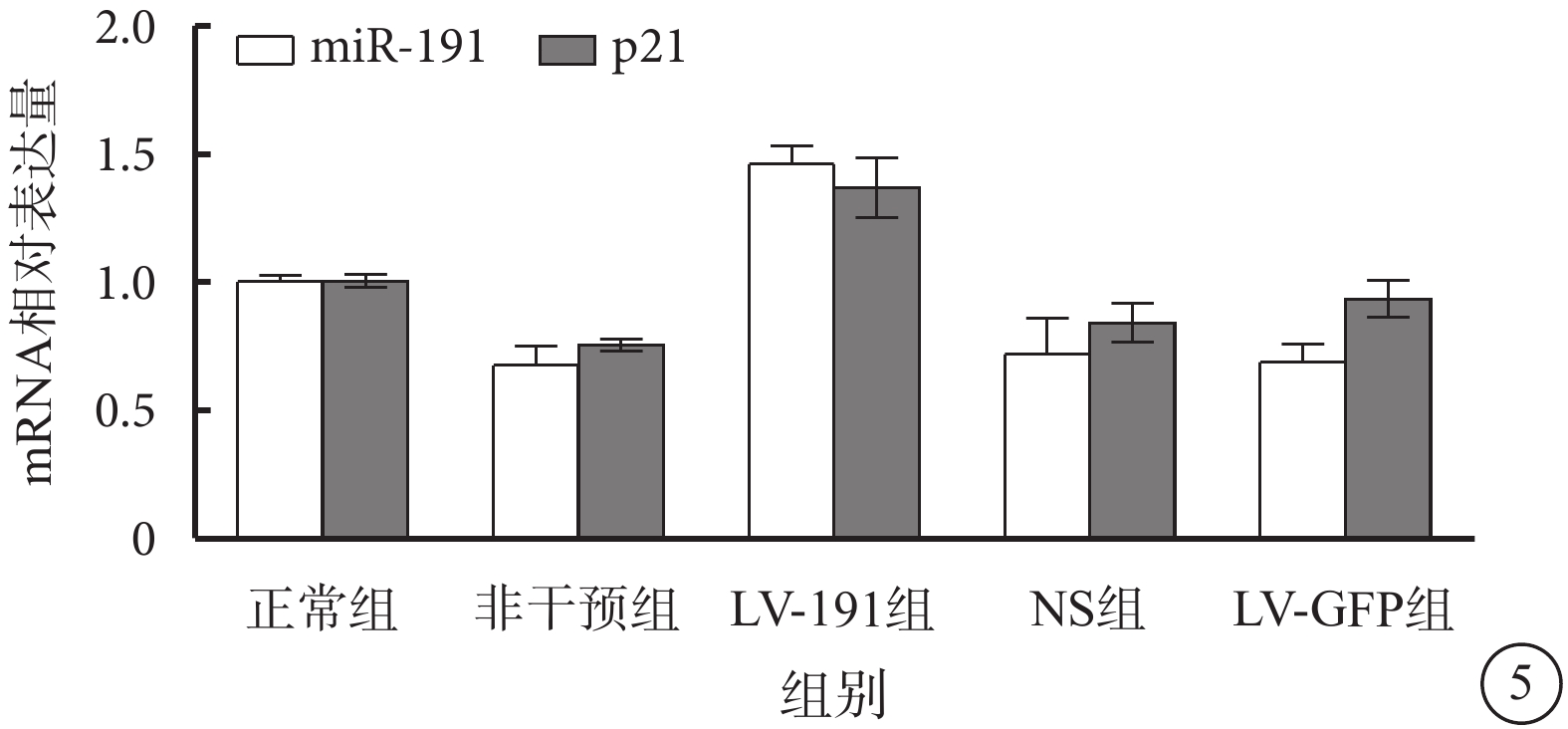 圖5
各組miR-191、p21 mRNA相對表達量比較
圖5
各組miR-191、p21 mRNA相對表達量比較
3 討論
慢病毒載體是以人類免疫缺陷型病毒為基礎的基因治療載體,能夠在體內或體外高效地轉染細胞,其免疫反應小,并且穩定表達,因而是目前較廣泛使用的基因轉染工具[11]。OIR模型是一個可靠并廣泛使用的視網膜疾病模型,熒光視網膜鋪片和石蠟切片HE染色是檢驗RNV模型是否成功的金標準[12]。本研究建立的RNV模型通過視網膜鋪片和石蠟切片HE染色確定模型制備成功。
RNV疾病主要包括糖尿病視網膜病變、早產兒視網膜病變、視網膜靜脈阻塞等。抗VEGF藥物治療可取得良好療效,但其持續時間有限[13]。近年,隨著對miRNA研究的不斷深入,發現多種miRNA在眼部的表達以及在RNV疾病中調節新生血管生成的作用。有研究表明,OIR小鼠玻璃體腔注射miR-150可抑制血管內皮細胞增生,進而抑制RNV的生成[13]。Wang等[14]研究發現,OIR小鼠玻璃體腔注射miR-329可通過抑制CD-146的表達從而抑制RNV的生成,但無灌注區面積未見明顯改善。本研究結果顯示,OIR小鼠玻璃體腔注射miR-191既可以減少RNV的生成,又可以減小無灌注區面積。此外,Chen等[4]發現玻璃體腔注射miR-410可減少VEGF-A的表達從而抑制RNV,而且同時發現miRNA-410通過眼液點眼同樣可抑制RNV,但具體機制不清。該研究不僅表明miRNA具有明顯抑制RNV的效果,而且滲透力較強。同樣,有研究發現玻璃體腔注射miR-31、miR-184及miR-218等也可通過不同途徑抑制RNV的生成[5-6]。
miR-191作為miRNA的一種,通過調控細胞增生、分化、凋亡以及遷移,參與多種疾病的發生、發展[7]。研究表明,miR-191可通過上調p21的表達,抑制血管生成[8];另有研究發現,miR-191通過下調CDK6抑制甲狀腺癌細胞的增生[15]。p21是細胞周期蛋白依賴激酶抑制因子,在細胞周期中起到負性調控作用。Kim等[16]研究發現,經迷迭香酸處理后的人視網膜微血管內皮細胞p21表達增高,細胞的成管能力明顯減弱,體內實驗證實迷迭香酸可通過上調p21表達抑制RNV的生成。Han和Li[17]的研究發現,通過上調p21的表達可以降低CDK2的表達,從而抑制視網膜微血管內皮細胞增生,達到抑制RNV的作用。本研究結果顯示,LV-191組小鼠視網膜無灌注區及RNV較非干預組、NS組、LV-GFP組明顯減少,突破內界膜血管內皮細胞核計數亦明顯減少。表明miR-191可以明顯抑制RNV生成,降低視網膜無灌注區面積。本研究結果進一步證實OIR小鼠眼內注射miR-191后p21表達明顯上調,并且抑制RNV的生成。miR-191可能通過調控p21參與RNV生成的抑制作用。
近年來,抗VEGF藥物治療在臨床中廣泛應用并取得了良好的效果。但是,抗VEGF藥物治療作用在RNV的終末節點,持續時間有限,并可能會影響到正常血管。因此,本研究從新的視角揭示RNV的發生機制,為防治RNV尋找新的靶點。miR-191通過多種途徑參與調控細胞的增生和遷移,包括核因子-kB信號途徑、細胞周期調控通路等。本研究結果表明,慢病毒介導miR-191可以通過細胞周期調控通路抑制視網膜血管內皮細胞增生,達到抑制RNV的作用。但病毒介導基因轉染的安全性問題,還需要進一步研究。
視網膜新生血管(RNV)疾病是導致視覺障礙的主要原因。異常增生的新生血管通過多種途徑受到多種因子的調節[1-2]。微小RNA(miR)作為一種大小約22個堿基的單鏈非編碼小分子RNA,參與基因轉錄后的表達調控,其廣泛存在于多細胞生物中,幾乎參與所有生物學過程[3-6]。miR-191作為miRNA的一種,通過調控細胞增生、分化、凋亡以及遷移,參與多種疾病的發生、發展[7],并且可以通過激活多種途徑抑制新生血管生成[8]。為進一步明確miR-191對RNV的抑制作用及機制,我們將慢病毒介導的miR-191轉染至小鼠視網膜,觀察RNV的生成情況,同時檢測視網膜組織中miR-191、p21的表達情況。現將結果報道如下。
1 材料和方法
攜帶miR-191(LV-191)、綠色熒光蛋白(LV-GFP)慢病毒載體由上海漢恒生物科技有限公司提供。逆轉錄試劑盒AE301由北京全式金生生物技術有限公司提供。
健康C57BL/6J小鼠80只,7日齡,平均體重(3.52±0.35)g,雌雄不限,清潔級;由斯貝福公司提供。飼養環境及實驗操作均符合國家科學技術委員會《實驗動物管理條例》的規定,并獲得天津醫科大學眼科醫院動物倫理委員會許可(動物倫理批號TJYY20190103002)。采用隨機數字表法將小鼠隨機分為正常組、非干預組、LV-191組、生理鹽水(NS)組、LV-GFP組,每組16只。參照文獻[9]的方法構建氧誘導RNV(OIR)小鼠模型。非干預組、LV-191組、NS組、LV-GFP組小鼠置于含氧體積分數為(75±2)%的飼養箱中,平均溫度維持在(23±2)℃,氧氣分析儀監測并調控飼養箱內的氧氣含量,5次/d;高氧環境下連續飼養5 d后,置于正常空氣環境中。正常組小鼠于正常空氣中飼養5 d,不做任何處理。小鼠12日齡時,LV-191組、NS組、LV-GFP組小鼠右眼玻璃體腔分別注射1 μl LV-191、NS、LV-GFP;非干預組小鼠不做玻璃體腔注射,置于正常空氣中飼養。
小鼠17日齡時,每組隨機選取4只小鼠腹腔注射10%水合氯醛處死。摘除眼球于4%多聚甲醛中室溫固定1 h,PBS中4 ℃保存。手術顯微鏡下剝離完整視網膜,4 ℃過夜固定。參照文獻[10]的方法對視網膜血管進行染色。染色后的標本以節細胞層向上平鋪于載玻片上,含DAPI的抗熒光衰退封片劑封片,熒光顯微鏡下用相同的光學參數拍照。手動測量無灌注區面積,并用該面積所占全視網膜面積的百分比表示。
小鼠17日齡時,每組隨機選取4只小鼠,處死方法同前。摘除眼球,標記方向后置于4%多聚甲醛中4 °C過夜。常規脫水、透明、浸蠟,石蠟包埋,矢狀面平行視神經連續切片,片厚5 μm,相鄰2張切片間隔30 μm,去掉含有視神經的切面。每只眼球選取10張切片,常規脫蠟后HE染色。雙盲法統計每張切片中突破視網膜內界膜的血管內皮細胞核數目,同時排除玻璃體腔與視網膜內界膜無聯系的血管內皮細胞核。
實時定量PCR(RT-PCR)檢測各組小鼠視網膜中p21、miR-191 mRNA相對表達量。小鼠17日齡時,每組選取8只小鼠,處死方法同前。摘除眼球,取出視網膜組織,Trizol一步法提取總RNA。按照逆轉錄試劑盒操作說明逆轉錄合成cDNA,以cDNA為模版進行PCR擴增,總反應體系200 μl。由北京擎科新業生物技術有限公司設計并合成p21及miR-191特異性引物。p21:正向引物:TGAAGCAGTCACAGCCTAGAA,反向引物:CAGGTCTGAGCAATGTCAAG,擴增片段長度80 堿基對;miR-191引物:CAACGGAATCCCAAAAGCAGC。PCR反應條件:95 °C預變性5 min,95 °C變性10 s,退火30 s,退火溫度60 °C,共40次循環。應用熔解曲線檢測產物特異性,60~97 °C緩慢增加溫度,每°C采集5次熒光,繪制成溶解曲線。目的基因擴增產物的相對含量應用2?ΔΔCT 2進行計算。
采用SPSS22.0軟件行統計學處理。所有數據以均數±標準差( )表示。組間比較采用單因素方差分析,兩兩比較采用Bonferroni事后檢驗。P<0.05為差異有統計學意義。
)表示。組間比較采用單因素方差分析,兩兩比較采用Bonferroni事后檢驗。P<0.05為差異有統計學意義。
2 結果
熒光顯微鏡觀察發現,正常組小鼠視網膜未見明顯無灌注區及RNV(圖1A);非干預組、NS組、LV-空白組小鼠視網膜均可見大量無灌注區和RNV(圖1B~1D);LV-191組小鼠視網膜可見少量無灌注區及RNV(圖1E)。正常組、非干預組、LV-191組、NS組、LV-空白組小鼠視網膜無灌注區面積比較,差異有統計學意義(F=127.20,P<0.001)(圖2)。非干預組小鼠視網膜無灌注區面積較正常組明顯增多,差異有統計學意義(P<0.001);LV-191組小鼠視網膜無灌注區面積分別較非干預組、NS組、LV-GFP組明顯減少,差異有統計學意義(P=0.000 2、0.000 1、0.000 4)
 圖1
各組小鼠視網膜血管鋪片熒光顯微鏡像。1A示正常組,視網膜未見明顯無灌注區及RNV;1B~1D分別示非干預組、NS組、LV-GFP組,視網膜大量無灌注區(黃色實線區域)和RNV;1E示LV-191組,視網膜少量無灌注區(黃色實線區域)及RNV 標尺:500 μm
圖1
各組小鼠視網膜血管鋪片熒光顯微鏡像。1A示正常組,視網膜未見明顯無灌注區及RNV;1B~1D分別示非干預組、NS組、LV-GFP組,視網膜大量無灌注區(黃色實線區域)和RNV;1E示LV-191組,視網膜少量無灌注區(黃色實線區域)及RNV 標尺:500 μm
 圖2
各組小鼠視網膜無灌注區相對面積定量比較。*P<0.05
圖2
各組小鼠視網膜無灌注區相對面積定量比較。*P<0.05
光學顯微鏡觀察發現,正常組小鼠未見突破內界膜的血管內皮細胞核(圖3A);LV-191組小鼠可見少量突破內界膜的血管內皮細胞核(圖3B);非干預組、NS組、LV-GFP組小鼠可見大量突破內界膜的血管內皮細胞核(圖3C~3E)。正常組、非干預組、LV-191組、NS組、LV-空白組小鼠突破內界膜的血管內皮細胞核計數比較,差異有統計學意義(F=31.71,P<0.05)(圖4)。非干預組小鼠突破內界膜的血管內皮細胞核計數較正常組明顯增多,差異有統計學意義(P<0.05);LV-191組小鼠突破內界膜的血管內皮細胞核計數較非干預組、NS組、LV-GFP組明顯減少,差異有統計學意義(P=0.002 0、0.002 3、0.001 6)。
 圖3
各組小鼠視網膜組織病理像。3A示正常組,未見突破內界膜的視網膜血管內皮細胞核;3B示LV-191組,可見少量突破內界膜的血管內皮細胞核(黑箭);3C~3E分別示非干預組、NS組、LV-GFP組,可見大量突破內界膜的血管內皮細胞核(黑箭) HE 標尺:20 μm
圖3
各組小鼠視網膜組織病理像。3A示正常組,未見突破內界膜的視網膜血管內皮細胞核;3B示LV-191組,可見少量突破內界膜的血管內皮細胞核(黑箭);3C~3E分別示非干預組、NS組、LV-GFP組,可見大量突破內界膜的血管內皮細胞核(黑箭) HE 標尺:20 μm
 圖4
各組小鼠突破內界膜的血管內皮細胞核計數定量比較。*P<0.05
圖4
各組小鼠突破內界膜的血管內皮細胞核計數定量比較。*P<0.05
RT-PCR檢測發現,正常組、非干預組、LV-191組、NS組、LV-GFP組小鼠視網膜中miR-191、p21 mRNA相對表達量比較,差異有統計學意義(F=10.95、15.60,P<0.05、<0.05)(圖5)。與正常組小鼠視網膜中miR-191、p21 mRNA相對表達量比較,LV-191組相對表達量明顯上調,差異有統計學意義(P<0.05);與非干預組、NS組、LV-空白組小鼠視網膜miR-191、p21 mRNA相對表達量比較,LV-191組相對表達量明顯上調,差異有統計學意義(P<0.05)。
 圖5
各組miR-191、p21 mRNA相對表達量比較
圖5
各組miR-191、p21 mRNA相對表達量比較
3 討論
慢病毒載體是以人類免疫缺陷型病毒為基礎的基因治療載體,能夠在體內或體外高效地轉染細胞,其免疫反應小,并且穩定表達,因而是目前較廣泛使用的基因轉染工具[11]。OIR模型是一個可靠并廣泛使用的視網膜疾病模型,熒光視網膜鋪片和石蠟切片HE染色是檢驗RNV模型是否成功的金標準[12]。本研究建立的RNV模型通過視網膜鋪片和石蠟切片HE染色確定模型制備成功。
RNV疾病主要包括糖尿病視網膜病變、早產兒視網膜病變、視網膜靜脈阻塞等。抗VEGF藥物治療可取得良好療效,但其持續時間有限[13]。近年,隨著對miRNA研究的不斷深入,發現多種miRNA在眼部的表達以及在RNV疾病中調節新生血管生成的作用。有研究表明,OIR小鼠玻璃體腔注射miR-150可抑制血管內皮細胞增生,進而抑制RNV的生成[13]。Wang等[14]研究發現,OIR小鼠玻璃體腔注射miR-329可通過抑制CD-146的表達從而抑制RNV的生成,但無灌注區面積未見明顯改善。本研究結果顯示,OIR小鼠玻璃體腔注射miR-191既可以減少RNV的生成,又可以減小無灌注區面積。此外,Chen等[4]發現玻璃體腔注射miR-410可減少VEGF-A的表達從而抑制RNV,而且同時發現miRNA-410通過眼液點眼同樣可抑制RNV,但具體機制不清。該研究不僅表明miRNA具有明顯抑制RNV的效果,而且滲透力較強。同樣,有研究發現玻璃體腔注射miR-31、miR-184及miR-218等也可通過不同途徑抑制RNV的生成[5-6]。
miR-191作為miRNA的一種,通過調控細胞增生、分化、凋亡以及遷移,參與多種疾病的發生、發展[7]。研究表明,miR-191可通過上調p21的表達,抑制血管生成[8];另有研究發現,miR-191通過下調CDK6抑制甲狀腺癌細胞的增生[15]。p21是細胞周期蛋白依賴激酶抑制因子,在細胞周期中起到負性調控作用。Kim等[16]研究發現,經迷迭香酸處理后的人視網膜微血管內皮細胞p21表達增高,細胞的成管能力明顯減弱,體內實驗證實迷迭香酸可通過上調p21表達抑制RNV的生成。Han和Li[17]的研究發現,通過上調p21的表達可以降低CDK2的表達,從而抑制視網膜微血管內皮細胞增生,達到抑制RNV的作用。本研究結果顯示,LV-191組小鼠視網膜無灌注區及RNV較非干預組、NS組、LV-GFP組明顯減少,突破內界膜血管內皮細胞核計數亦明顯減少。表明miR-191可以明顯抑制RNV生成,降低視網膜無灌注區面積。本研究結果進一步證實OIR小鼠眼內注射miR-191后p21表達明顯上調,并且抑制RNV的生成。miR-191可能通過調控p21參與RNV生成的抑制作用。
近年來,抗VEGF藥物治療在臨床中廣泛應用并取得了良好的效果。但是,抗VEGF藥物治療作用在RNV的終末節點,持續時間有限,并可能會影響到正常血管。因此,本研究從新的視角揭示RNV的發生機制,為防治RNV尋找新的靶點。miR-191通過多種途徑參與調控細胞的增生和遷移,包括核因子-kB信號途徑、細胞周期調控通路等。本研究結果表明,慢病毒介導miR-191可以通過細胞周期調控通路抑制視網膜血管內皮細胞增生,達到抑制RNV的作用。但病毒介導基因轉染的安全性問題,還需要進一步研究。