四川大學華西附二院丁楅森教授團隊在自然出版社與川大華西醫院生物治療國家重點實驗室聯合主辦的 《Signal Transduction and Targeted Therapy》(STTT)上發表了發表研究性文章,發現小鼠肝修復分子機制,傳統被認為僅有凝血功能的血小板細胞還具有調節器官再生的功能。(http://www.nature.com/articles/sigtrans201635,閱讀原文及下載PDF可直接點擊本文最下方“閱讀原文”),文章的第一作者為康奈爾大學醫學院Koji Shido,由當時仍在康奈爾大學的丁楅森教授指導完成,本文通訊作者為丁楅森教授。

許多疾病能導致器官失去原有功能,而引導病變器官進行再生,從而恢復原有器官功能可為這些疾病提供治療手段,遺憾的是,哺乳動物成體器官再生的具體機制仍不清楚。眾所周知,極少數哺乳動物的器官本身就具有一定的再生能力,如肝臟。哺乳動物的肝臟具有極強的再生能力,即使手術切除或化學損傷70%的小鼠和人的肝臟組織,它仍然具有重新生長功能肝組織的能力。因此揭示哺乳動物肝臟再生機制對研究人員設計病變器官的再生治療手段具有指導作用。
在以前的研究中,丁教授團隊已經發現,在組織再生和修復中,血管內皮血細胞通過表達旁分泌(angiocrine)因子形成引導性的微環境(Vascular Niche),從而在各個階段調控肝和肺組織的再生和修復。
在小鼠的肝修復過程中,局部活化的血小板可通過激活引導性的血管微環境促進肝組織的再生,而這一過程是由血小板表達的stromal derived factor-1 (SDF-1)通過激活血管內皮細胞特異性受體CXCR7來介導的。CXCR7受體在肝竇血管內皮細胞中被激活會導致組織特異性的旁分泌因子Hepatocyte growth factor(HGF)和Wnt2的表達。這些血管表達的生長因子共同作用于與血管緊密接觸的肝細胞,促進肝細胞的增值和肝組織結構和功能的回復。體內和體外原代細胞培養實驗顯示在肝血管微環境中銜接CXCR7受體和下游旁分泌因子HGF表達的是一個獨特的轉錄調控因子Inhibitor of DNA binding 1 (Id1)。因此在損傷肝中,血小板通過激活肝血管微環境CXCR7-Id1-HGF/Wnt2通路控制肝的再生修復反應(下圖)。該研究發現,傳統被認為僅有凝血功能的血小板細胞還具有新穎的調節器官再生的功能。
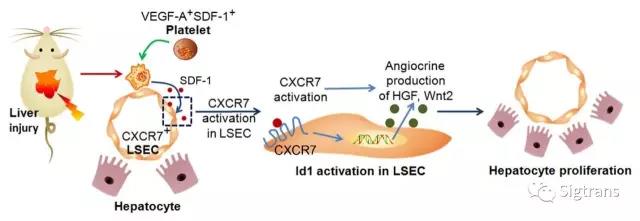
LSEC: liver sinusoidal endothelial cell,肝竇血管內皮細胞
Angiocrine: endothelial paracrine
作為傳統觀點認知的凝血細胞,循環的血小板在組織修復有著不可替代的重要作用。但是對血小板在損傷組織中的功能的研究大多局限于其促進血栓形成和調節免疫的功能。而血小板作為最豐富的循環血細胞之一,攜帶有大量的蛋白和脂分子如SDF-1。這些由血小板攜帶的分子可調控多種生理病理過程。本研究揭示,除了在傳統的止血和炎癥中發揮作用之外,血小板可以通過釋放細胞活化分子激活血管微環境促進肝再生。在該研究中,研究人員通過缺失血小板的Thrombopoiein敲除小鼠的肝切除和四氯化碳肝損傷這兩種小鼠肝修復模型證明了血小板的促再生功能。在Thrombopoiein敲除小鼠中,肝細胞增值和肝功能恢復的速度均低于對照組小鼠,進一步的研究發現,Thrombopoiein敲除小鼠肝血管微環境中促再生的CXCR7-Id1-HGF/Wnt2通路的被抑制。研究發現,肝損傷后,富含SDF-1的活化血小板富集于肝竇狀血管的內皮細胞上,同時,SDF-1的受體CXCR7在肝竇狀血管內皮細胞中特異性上調。為了進一步研究CXCR7的作用,研究人員還采用了血管內皮細胞特異性的Cxcr7敲除鼠進行驗證,結果發現CXCR7通路在肝血管微環境中確實發揮著促再生作用。注射SDF-1則在Thrombopoiein敲除鼠中增強了肝再生。因此,結合Thrombopoiein和內皮特異性的Cxcr7敲除鼠,該研究最終確認了血小板產生的SDF-1和血管微環境中的CXCR7的相互作用是肝再生所必須的細胞間相互作用。最終,由激活的血管內皮細胞產生的旁分泌分子(定義為Angiocrine)通過刺激肝細胞增殖而使得肝再生。血小板-肝竇血管內皮細胞-肝細胞在肝修復中的相互作用是血小板調控肝再生的關鍵(如下圖)
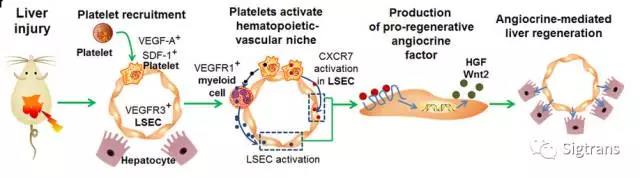
該研究顯示血小板和血管內皮細胞形成Hematopoietic-Vascular Niche可促進肝細胞增值,從而引導肝再生,為研究哺乳動物的成體器官的再生的細胞分子機制,尤其是作為微環境的血液和血管細胞是如何形成“引導性微環境”(Hematopoietic-Vascular Niche)控制器官再生提供了新視角。該研究還提示血小板或血液細胞移植手段有可能作為肝部疾病的再生治療選擇。
參考文獻:
(1). Cao Z*, Lis R, Ginsburg M, Chavez D, Shido K, Rabbany SY, Fong GH, Sakmar TP, Rafii S*, Ding BS*. Targeting of pulmonary capillary vascular niche promotes lung alveolar repair and ameliorates fibrosis. Nature Medicine 2016, 22(2):154-62 (Journal Cover) (*Corresponding author). PMID 26779814
(2). Ding BS, Nolan DJ, Butler JM, James D, Babazadeh AO, Rosenwaks Z et al. Inductive angiocrine signals from sinusoidal endothelium are required for liver regeneration. Nature 2010; 468: 310–315.
(3). Ding BS, Liu CH, Sun Y, Chen Y, Swendeman SL, Jung B et al. HDL activation of endothelial sphingosine-1-phosphate receptor-1 (S1P1) promotes regeneration and suppresses fibrosis in the liver. JCI Insight 2016; 1: e87058.
(4). Rafii S, Cao Z, Lis R, Siempos II, Chavez D, Shido K,Ding BS et al.Platelet-derived SDF-1 primes the pulmonary capillary vascular niche to drive lung alveolar regeneration. Nat Cell Biol 2015; 17: 123–136.
(5). Ding BS, Nolan DJ, Guo P, Babazadeh AO, Cao Z, Rosenwaks Z et al.Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell 2011; 147: 539–553.
(6). Ding BS, Cao Z, Lis R, Nolan DJ, Guo P, Simons M et al.Divergent angiocrine signals from vascular niche balance liver regeneration and fibrosis. Nature 2014; 505: 97–102.
(7). Rafii S, Butler JM, Ding BS.Angiocrine functions of organ-specific endothelial cells. Nature 2016; 529: 316–325.
(8). Cao Z, Ding BS, Guo P, Lee SB, Butler JM, Casey SC et al.Angiocrine factors deployed by tumor vascular niche induce B cell lymphoma invasiveness and chemoresistance. Cancer Cell 2014; 25: 350–365.
(9).Cao Z, Scandura JM, Inghirami GG, Shido K, Ding BS, Rafii S. Molecular checkpoint decisions made by subverted vascular niche transform indolent tumor cells into chemoresistant cancer stem cells. Cancer Cell 2017; 31: 110–126.
丁楅森教授團隊簡介

左:Dr. Koji Shido;中:丁楅森教授;右:Dr. Deebly Chavez
丁楅森教授,青年千人計劃學者、長江學者特聘教授。于2015年從美國康奈爾大學回到四川大學華西第二醫院/生物治療國家重點實驗室。丁楅森課題組以前發表于”Cell”, “Nature”, “Cancer Cell”, “JCI Insight”的一系列研究證明在組織再生和修復中,血管內皮血細胞通過表達旁分泌(angiocrine)因子形成引導性的微環境(Vascular Niche),從而在各個階段調控肝和肺組織再生和修復。而其后發表于”Nature Medicine” 和“Nature Cell Biology”工作進一步顯示了血液和內皮細胞可以共同形成血液和血管微環境引導肺再生。這次的研究在這些工作的基礎上進一步顯示血小板和血管內皮細胞形成Hematopoietic-Vascular Niche促進肝細胞增值,從而引導肝再生。
丁楅森教授個人網頁:
https://www.researchgate.net/profile/Bi-Sen_Ding/publications
Signal Transduction and Targeted Therapy簡介
《Signal Transduction and Targeted Therapy》(STTT)是自然出版集團和四川大學華西醫院生物治療國家重點實驗室合作出版的全英文生物醫學專業期刊(網站:http://www.nature.com/sigtrans,點擊本網站最下方"閱讀原文”)。主編由美國俄亥俄州立大學Carlo M. Croce教授(美國三院院士,Cancer Research前主編),UCSD的張康教授、川大華西醫院魏于全教授/院士擔任。有來自全球等多個國家及地區的多位相關領域的近百位著名學者組成編委會。本雜志每周五發表文章,歡迎各位投稿,包括論著或綜述。對于原創性成果采取“快速通道”模式,幫助作者以最快的速度發表文章,最快一周可接收。該雜志發表論文可免收發表費。該雜志投稿格式不限,正式發表之前再按雜志格式修改。感謝將此信息轉發給您們的同事、朋友以及學生等。
Cite this article Koji Shido, Deebly Chavez, Zhongwei Cao, Jane Ko, Shahin Rafii and Bi-Sen Ding. Platelets prime hematopoietic–vascular niche to drive angiocrine-mediated liver regeneration. Signal transduction and targeted therapy,1. (2016). doi:10.1038/sigtrans.2016.44
點擊下方“閱讀原文”可查看原文并免費下載PDF