上海交通大學的房靜遠教授和許杰研究員在自然出版社與川大華西醫院生物治療國家重點實驗室聯合主辦的 《Signal Transduction and Targeted Therapy》(STTT)上發表了發表研究性文章,發現了ASAP3-Arf6信號調控胃酸分泌的新機制,并證實其作為胃潰瘍和胃食管返流等酸相關疾病干預的新靶點。(http://www.nature.com/articles/sigtrans20175,閱讀原文及下載PDF可直接點擊本文最下方“閱讀原文”)。該文的通訊作者是房靜遠教授和許杰研究員,第一作者是錢縉博士和李月元博士。

胃酸分泌的增多或減少可以引起的上消化道疾病十分常見,例如胃酸增多引起的胃潰瘍和反流性食管炎等。因此質子泵抑制劑(PPI)等抗酸藥物在世界范圍內的使用量位居前列。PPI的作用靶標是位于壁細胞頂部分泌小管上的質子泵,又稱H, K-ATPase。盡管PPI在大多數病人中有效,但停藥后的胃酸反彈性上升現象和耐受是主要的兩個缺點。有報道稱,標準劑量的質子泵抑制劑治療下高達百分之三十的胃食管反流病患者仍有明顯癥狀。因此,開發新的胃酸干預方法是治療酸相關疾病的重要研究課題。
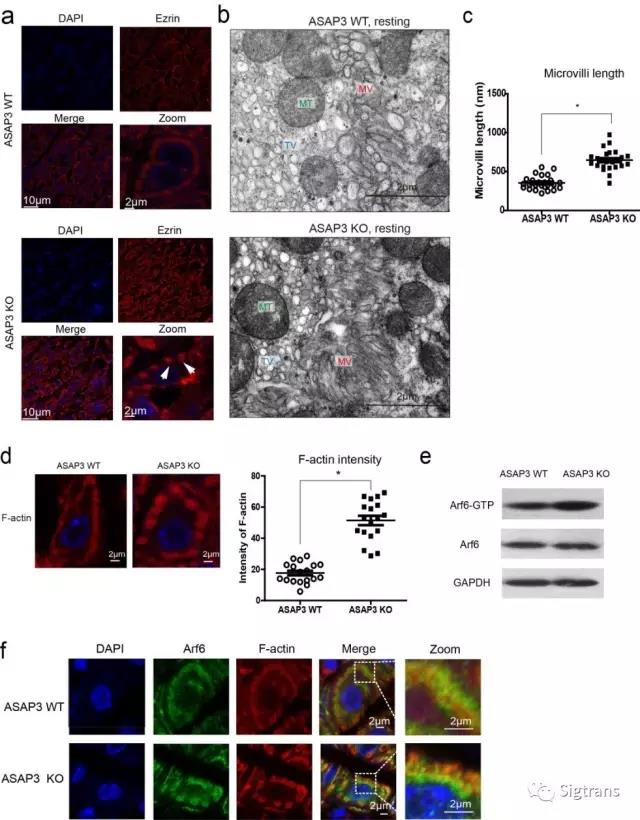
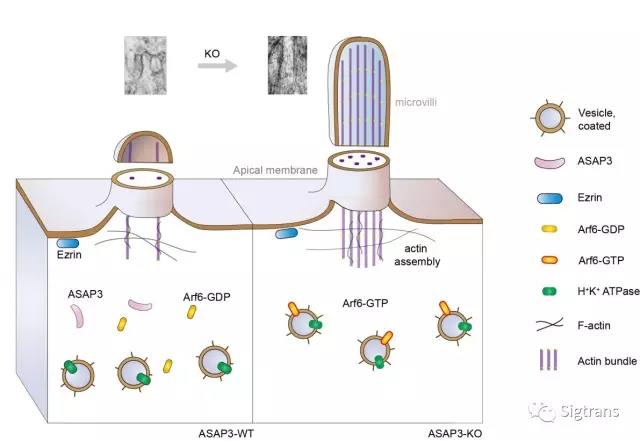
房靜遠和許杰研究團隊構建了ASAP3條件敲除小鼠并認真分析其表型,發現胃壁細胞的微絨毛結構發生異常延長,并堵塞分泌管腔結構,導致酸無法泌出。ASAP3的缺失導致Arf6持續激活,并使微管內的肌動蛋白過度組裝,從而導致前述的微絨毛延長現象。這是首次發現ASAP3在微絨毛結構調控中的關鍵作用,表明ASAP3對胃酸分泌具有多層次的調控作用,并不僅限于以往體外實驗發現的影響質子泵轉位作用(下圖)。
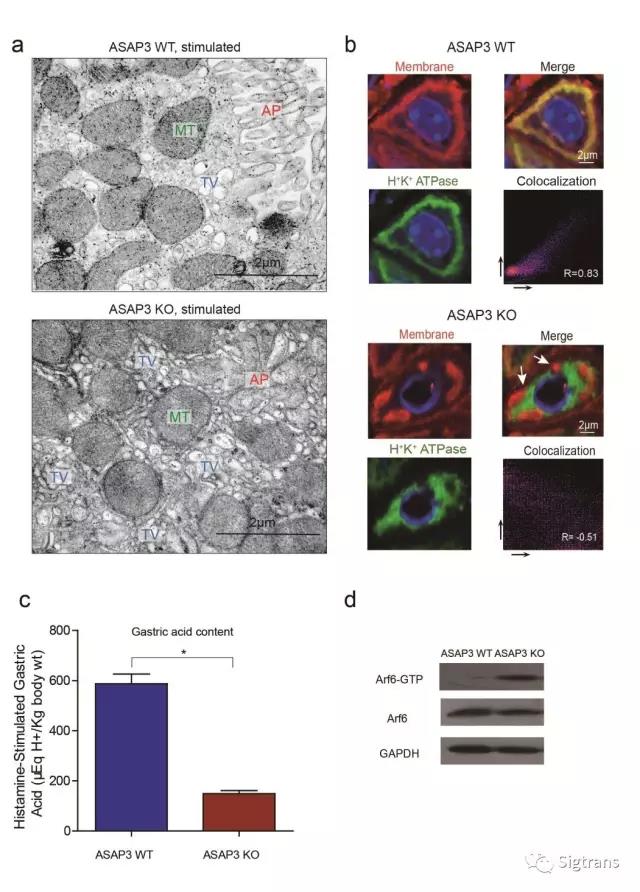
組胺刺激后,Arf6的持續激活導致壁細胞微絨毛的膜結構過度膨脹,進一步加重了分泌管腔的封閉,降低刺激后的胃酸分泌量(下圖)。
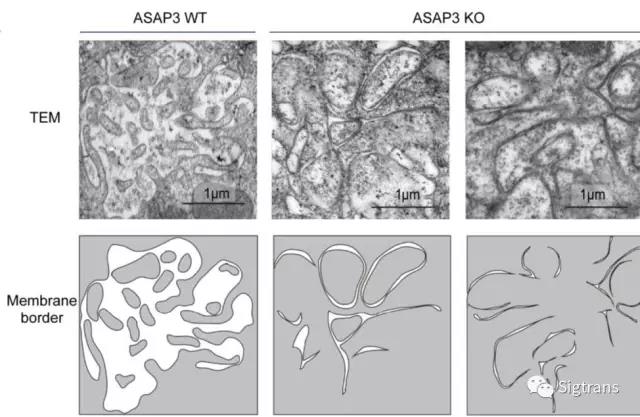
電鏡分析顯示ASAP3-/-小鼠壁細胞的分泌管腔空間嚴重狹窄(見下圖)。
分子模擬提示ASAP3的BAR“香蕉狀”結構域可以誘導磷脂雙層形成半徑為40nm的弧形彎曲,而電鏡發現微絨毛根部多見這種形態的膜結構。提示ASAP3可能結合于微絨毛底部,定向運送Arf6標記的囊泡(見下圖)。
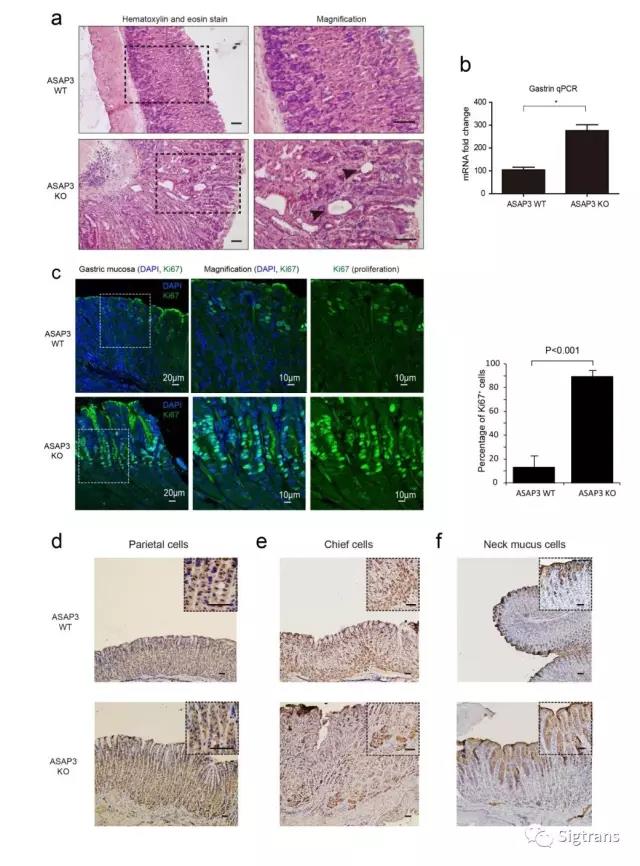
敲除ASAP3導致胃壁細胞數量減少、胃泌素代償增加、黏液細胞增生活躍,胃上皮組織增生肥厚(見下圖)。

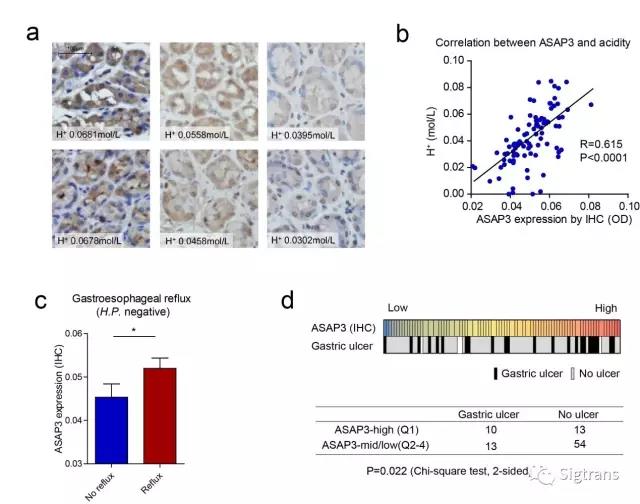
研究者分析了90例病人的胃酸分泌量與ASAP3表達的相關性,結果表明ASAP3的表達和基礎胃酸分泌量顯著正相關,且ASAP3表達升高與胃潰瘍和胃食管返流疾病有關(下圖)。
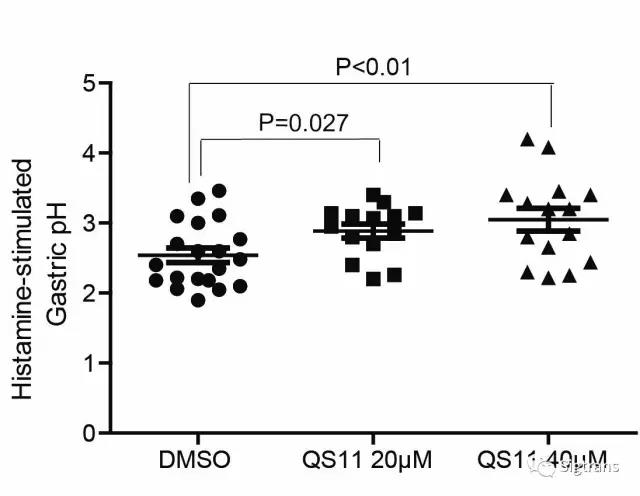
作者積極進行轉化醫學研究,發現利用QS11小分子可以調控ASAP3-Arf6通路的活性并抑制小鼠胃酸的分泌。該作用呈現出劑量依賴效應(下圖)。
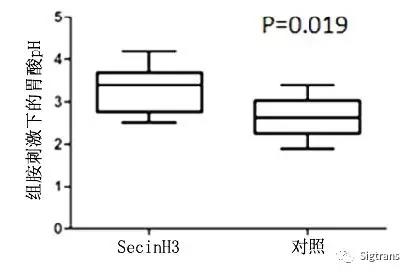
研究者使用Arf6的抑制劑SecinH3注射實驗小鼠,觀察到了更強的抑酸作用,這提示SecinH3具備更好的實用性(下圖)。研究者申請了相關的專利“SecinH3 在制備抑制胃酸分泌藥物中的應用”。
在此次研究中,房靜遠教授和許杰研究員的團隊發現:抑制胃酸存在一種新的有效途徑,即調控ASAP3-Arf6通路,封閉分泌管腔并抑制質子泵的轉位,從而阻斷胃酸分泌(機制如下圖)。這種新方法的作用方式不同于廣泛使用的PPI,為PPI治療效果不佳的胃潰瘍或為食管返流患者帶來新的希望。這拓寬了人們進行酸相關疾病治療的思路,并且揭示了ASAP3-Arf6通路在抑酸藥物開發中的潛在價值。
綜上所述,該研究團隊經過長期的研究,結合ASAP3基因敲除模型、臨床隊列研究以及小分子體內靶向干預等方法,證實了ASAP3-Arf6信號途徑對于壁細胞微絨毛結構的調控作用以及對胃酸分泌的顯著影響;通過QS11、SecinH3等小分子有效調控ASAP3-Arf6通路活性并降低胃酸分泌,為胃酸分泌相關疾病如胃潰瘍、反流性食管炎等疾病的治療提供了新靶點和思路。該團隊將這一重要的轉化醫學研究成果以ASAP3 regulates microvilli structure in parietal cells and presents intervention target for gastric acidity為題發表了STTT。
參考文獻:
(1). Weng YR, Kong X, Yu YN, Wang YC, Hong J, Zhao SL et al. The role of ERK2 in colorectal carcinogenesis is partly regulated by TRAPPC4. Mol Carcinog 2014; 53(Suppl 1): E72–E84.
(2). Wang JL, Chen ZF, Chen HM, Wang MY, Kong X, Wang YC et al. Elf3 drives betacatenin transactivation and associates with poor prognosis in colorectal cancer. Cell Death Dis 2014; 5: e1263.
(3). Bai Y, Du Y, Zou D, Jin Z, Zhan X, Li ZS et al. Gastroesophageal Reflux Disease Questionnaire (GerdQ) in real-world practice: a national multicenter survey on 8065 patients. J Gastroenterol Hepatol 2013; 28: 626–631.
房靜遠教授團隊簡介

房靜遠教授,上海市消化疾病研究所所長,“長江學者”特聘教授,國家杰出青年科學基金獲得者,“百千萬人才工程”國家級人選,國家自然科學基金創新研究群體負責人、教育部創新團隊負責人。多年來致力于研究消化系統疾病發生機制和診療方法。在Cancer Discovery, Lancet Oncology, JNCI, Cell Research, Clinical Cancer Research等期刊發表了多篇了論文,主編了《整合大腸腫瘤學》等專著。

許杰研究員,國家優青、萬人計劃“青年拔尖人才”,上海市浦江學者、曙光學者、東方學者特聘教授。致力于研究囊泡轉運和細胞物流系統在消化系統疾病發生中的作用。發表了Nature Chemical Biology, Nature Communications, Cell Reports, JNCI, Gut, Cancer Research, Oncogene等論文。
Signal Transduction and Targeted Therapy簡介
《Signal Transduction and Targeted Therapy》(STTT)是自然出版集團和四川大學華西醫院生物治療國家重點實驗室合作出版的全英文生物醫學專業期刊(網站:http://www.nature.com/sigtrans,點擊本網站最下方"閱讀原文”)。主編由美國俄亥俄州立大學Carlo M. Croce教授(美國三院院士,Cancer Research前主編),UCSD的張康教授、川大華西醫院魏于全教授/院士擔任。有來自全球等多個國家及地區的多位相關領域的近百位著名學者組成編委會。本雜志每周五發表文章,歡迎各位投稿,包括論著或綜述。對于原創性成果采取“快速通道”模式,幫助作者以最快的速度發表文章,最快一周可接收。該雜志發表論文可免收發表費。該雜志投稿格式不限,正式發表之前再按雜志格式修改。感謝將此信息轉發給您們的同事、朋友以及學生等。
Cite this article Jin Qian, Yueyuan Li, Han Yao, Haiying Tian, Huanbin Wang, Luoyan Ai, Yuanhong Xie, Yujie Bao, Lunxi Liang, Ye Hu, Yao Zhang, Jilin Wang, Chushu Li, Jiayin Tang, Yingxuan Chen, Jie Xu and Jing-Yuan Fang. ASAP3 regulates microvilli structure in parietal cells and presents intervention target for gastric acidity. Signal Transduction and Targeted Therapy (2017) 2, e17003; doi:10.1038/sigtrans.2017.3
點擊下方“閱讀原文”可查看原文并免費下載PDF